选择题
化学与生活生产密切相关。下列说法中错误的是()
- A、 施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
- B、 夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率
- C、 施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
- D、 将海水直接电解可获得 Mg及Cl2等单质
下列物质溶于水后溶液显酸性的是()
- A、 NaHCO3
- B、 NH4NO3
- C、 Na2SO4
- D、 CH3OH
下列离子方程式中,属于盐类水解反应的是()
- A、 Na2CO3溶液:CO32-+2H2O
 H2CO3 +2OH-
H2CO3 +2OH- - B、 NaHCO3溶液:HCO3-+H2O
 CO32-+H3O+
CO32-+H3O+ - C、 NaHS溶液:HS-+H2O
 H2S+OH-
H2S+OH- - D、 KF溶液:F-+H2O=HF+OH-
下表中物质的分类组合完全正确的是()
| 编号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
| 弱电解质 | NH3·H2O | CaCO3 | HClO | C2H5OH |
| 非电解质 | SO2 | Al | H2O | CH3COOH |
- A、 A
- B、 B
- C、 C
- D、 D
一定体积的稀盐酸与过量的铝条反应,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加入适量的()
- A、 NaCl固体
- B、 CH3COOK溶液
- C、 Na2CO3溶液
- D、 CuCl2 溶液
下列说法或表示方法中错误的是()
- A、 在同温同压下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
- B、 室温下,pH=2的盐酸与pH=12的氨水等体积混合,溶液呈碱性
- C、 氢氧化钡晶体与氯化铵晶体的反应属于吸热反应
- D、 常温下,0.1mol·L-1的NaOH溶液和0.06mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=2
下列事实能用勒夏特列原理解释的是()
- A、 SO2氧化成SO3的反应,往往需要使用催化剂
- B、 H2、I2(g)、HI平衡混合气加压后颜色加深
- C、 工业上采用高压条件合成氨气
- D、 在硫酸亚铁溶液中加入铁粉以防止氧化变质
为证明某一元酸HR是弱酸,下列实验方法错误的是()
- A、 室温时,测定0.01mol·L-1的HR溶液的pH=4
- B、 室温时,往NaR溶液中滴加无色酚酞试液,溶液变红色
- C、 相同条件下,对浓度均为0.1 mol·L-1盐酸和HR溶液进行导电性实验
- D、 0.1mol·L-1的HR溶液与同体积0.1 mol·L-1的氢氧化钠溶液恰好完全反应
常温下,下列各组离子在指定溶液中,一定能大量共存的是()
- A、 在pH=13的溶液中:K+、Mg2+、Cl-、SO32-
- B、 c(H+)/c(OH-)=1×1012的溶液:Cu2+、Na+、Cl-、NO3-
- C、 无色溶液中:Fe3+、NH4+、Cl-、SO42-
- D、 由水电离出c(OH-)=1.0×10-12mol·L-1的溶液中:Al3+、NH4+、Cl-、SO42-
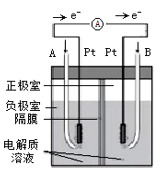
下列有关装置图的叙述中正确的是()
装置①  装置②
装置② 
装置③  装置④
装置④ 
- A、 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
- B、 装置②的总反应式:Cu+2Fe3+=Cu2++2Fe2+
- C、 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
- D、 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
下列实验操作能达到目的的是()
- A、 在中和热的测定实验中,可将稀盐酸换成浓硫酸
- B、 欲除去水垢中的CaSO4 , 可先用碳酸钠溶液处理,再用盐酸处理
- C、 用标准盐酸滴定未知浓度的NaOH溶液,用蒸馏水洗净滴定管后,可直接装入标准盐酸进行滴定
- D、 配制氯化铁溶液时,将氯化铁固体溶解在较浓的硫酸中再加水稀释
下列有关电解质溶液的说法正确的是()
- A、 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中导电粒子的数目减少
- B、 升高CH3COONa溶液的温度,溶液中
 增大
增大 - C、 盐酸与氨水恰好完全反应,则溶液中c(H+)=c(OH-)
- D、 向AgCl的饱和溶液中加入少量AgNO3溶液,则溶液中c(Ag+)·c(Cl-)保持不变
常温下,几种弱酸的电离平衡常数如下表所示,下列说法正确的是()
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
- A、 酸性强弱顺序是:HCOOH>HCN>H2CO3
- B、 物质的量浓度均为0.1mol·L-1的HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa<NaCN
- C、 HCOOH的电离平衡常数表达式为K=

- D、 H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+2CN-=2HCN+CO32-
在一定条件下,密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是()
CO(g)+3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是()

- A、 p1>p2
- B、 ΔH<0
- C、 加入催化剂可以提高甲烷的转化率
- D、 恒温下,缩小容器体积,平衡后CH4浓度减小
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应  ,经4min后达平衡,测得D的浓度为1.0mol·L-1 , c(A):c(B)=2:3,以C表示的平均速率υ(C)=0.125mol·L-1·min-1 , 下列说法错误的是()
,经4min后达平衡,测得D的浓度为1.0mol·L-1 , c(A):c(B)=2:3,以C表示的平均速率υ(C)=0.125mol·L-1·min-1 , 下列说法错误的是()
- A、 反应速率υ(A)=0.25mol·L-1·min-1
- B、 该反应方程式中,x=1
- C、 4 min时,B的物质的量为2mol
- D、 该反应的平衡常数K=
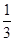
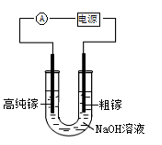
含有某些含氧酸根杂质的粗KOH溶液可用电解法提纯,其工作原理如图所示。下列有关说法正确的是()

- A、 装置右侧发生的电极反应式为:

- B、 通电后阴极区附近溶液pH会减小
- C、 m是电源负极
- D、 纯净的KOH溶液从b出口导出
硫代硫酸钠溶液与稀硫酸可发生反应:  ,某同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
,某同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。
设计实验如下
| 实验编号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| ① | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ② | 25 | 5 | 0.2 | 5 | 0.1 | 10 |
| ③ | 25 | 5 | 0.1 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.2 | 5 | 0.1 | 10 |
| ⑤ | 50 | 8 | 0.1 | 5 | 0.1 | V1 |
下列说法正确的是()
- A、 实验①和实验④中最先出现浑浊的是实验①
- B、 其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和实验④
- C、 选择实验①和实验③,测定混合液变浑浊的时间,可探究硫酸浓度对化学反应速率的影响
- D、 选择实验④和实验⑤,可探究Na2S2O3的浓度对反应速率的影响,则V1=10mL
室温下,将0.1000mol·L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是()

- A、 b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+)
- B、 室温下,MOH的电离平衡常数Kb为1×10-5
- C、 c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-)
- D、 d点处的溶液中c(MOH)+c(H+)=c(OH-)
 图②
图②