单选题
下面的表述错误的是( )
- A、 食盐水、二氧化硫、酒精、氯水的消毒杀菌原理各不相同
- B、 硅酸钠溶液可用于生产黏合剂和防火剂
- C、 蔡伦利用树皮、碎麻布、麻头等原料精制出优质纸张
- D、 杜康用高粱酿酒的原理,是通过蒸馏法将高粱中的乙醇分离出来
下列有关说法正确的是( )
- A、 氧化钾溶于水能导电,所以氧化钾是电解质
- B、 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键
- C、 酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物
- D、 纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的
、
、
、
等重金属离子
阿伏加德罗常数约为6.02×1023mol−1 , 下列叙述中正确的是( )
- A、 常温常压下,18.0g重水(D2O)所含的电子数约为10×6.02×1023个
- B、 一定条件下,46.0g二氧化氮和四氧化二氮的混合气体中含有的氮原子数约为6.02×1023个
- C、 已知:CO(g)+2H2(g)
CH3OH(g)ΔH=-91kJ·mol-1 , 一定条件下若加入6.02×1023个CO和2×6.02×1023个H2 , 则放出91kJ的热量
- D、 T℃时,1LpH=6纯水中,含10-8×6.02×1023个OH-
现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
Ⅰ.原子半径:甲<丙<乙<丁
Ⅱ.原子的最外层电子数:甲+丙=乙+丁=8
Ⅲ.原子的核外电子层数:丁>乙=丙=2甲
Ⅳ.乙元素的主要化合价:最高正价+最低负价=2
则下列说法错误的是( )
- A、 乙元素的最外层有5个电子,其氢化物含有极性键
- B、 四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强
- C、 丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物恰好完全反应形成的盐溶液显酸性
- D、 乙、丙两元素形成的简单氢化物稳定性丙的强于乙
下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )

- A、 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
- B、 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
- C、 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
- D、 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
CuBr是一种白色晶体,见光或潮湿时受热易分解,在空气中逐渐变为浅绿色。实验室制备CuBr的反应原理为:SO2+2CuSO4+2NaBr+ 2H2O=2CuBr↓+2H2SO4+Na2SO4 , 用下列装置进行实验,不能达到实验目的的是( )

- A、 用装置甲制取SO2
- B、 用装置乙制取CuBr
- C、 用装置丙避光将CuBr与母液分离
- D、 用装置丁干燥CuBr
以高硫铝土矿(主要成分为  、
、  ),还含有少量
),还含有少量  )为原料,生产氧化铝并获得
)为原料,生产氧化铝并获得  的部分工艺流程如下:
的部分工艺流程如下:

下列叙述错误的是( )
- A、 加入
可以减少
的排放同时生成建筑材料
- B、 向滤液中通入过量
、过滤、洗涤、灼烧沉淀可制得
- C、 隔绝空气焙烧时理论上反应消耗的
- D、 “烧渣分离”可以选择用磁铁将烧渣中的
分离出来
25℃时,弱酸的电离平衡常数如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
- A、 a mol·L-1HCN与b mol·L-1NaOH溶液等体积混合后c(Na+) > c(CN-),则a一定小于b
- B、 等pH的溶液物质的量浓度关系:c(CH3COONa) > c(NaHCO3) > c(NaCN)
- C、 用等pH的CH3COOH与HCN中和等物质的量的NaOH,所用CH3COOH溶液的体积小于HCN溶液的体积
- D、 NaHCO3和Na2CO3的混合液中:c(Na+) +c(H+)=c(OH-)+ c(HCO3-)+c(CO32-)
据图中氮元素及其化合物的转化关系,判断下列说法错误的是( )

- A、 X是N2O5
- B、 由NH3→N2 , 从原理上看,NH3可与NO2反应生成N2
- C、 工业上以NH3、空气、水为原料生产硝酸
- D、 可用NaOH溶液处理多余的NO气体
常压下羰基化法精炼镍的原理为  。
。  时,该反应的平衡常数
时,该反应的平衡常数  。
。
已知: 的沸点为
,固体杂质不参与反应。
第一阶段:将粗镍与 反应转化成气态
;
第二阶段:将第一阶段反应后的气体分离出来,加热至 制得高纯镍。
下列判断正确的是( )
- A、
是离子化合物
- B、 第一阶段,反应体系的温度应控制在
以上,以达到气化分离的目的
- C、 反应达到平衡状态以后,保持体积不变通入
,平衡正向移动,反应的平衡常数增大
- D、 第二阶段,可以通过增大压强来提高
分解率
在一定的温度下,将一定量的氢气和氮气的混合气体充入等压密闭容器中进行反应,达到平衡时维持温度不变,测得混合气体的密度是反应前密度的1.25倍,则达到平衡时,氨气的体积分数为( )
- A、 25%
- B、 27.5 %
- C、 30%
- D、 37.5%
CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg  与温度(t)的关系曲线如右图。下列说法正确的是( )
与温度(t)的关系曲线如右图。下列说法正确的是( )

- A、 通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
- B、 CO不适宜用于工业冶炼金属Cr
- C、 CO还原PbO2的反应△H>0
- D、 工业冶炼金属Cu时,高温有利于提高CO的转化率
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)  zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )

- A、 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
- B、 由图②知反应xA(g)+yB(g)
zC(g)的ΔH>0,且a=2
- C、 若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
- D、 200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5
一种使用  (二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂-空气电池的实验模型,这种实验电池在充放电100次以后,其电池容量仍能保持最初的95%。该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置如图所示。下列有关叙述正确的是( )
(二甲亚砜)作为电解液,并用多孔的黄金作为电极的锂-空气电池的实验模型,这种实验电池在充放电100次以后,其电池容量仍能保持最初的95%。该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂,其装置如图所示。下列有关叙述正确的是( )

- A、
电解液可以换成水溶液仍能正常工作
- B、 负极的电极反应式为
,生成的
从左向右移动
- C、 该电池放电时每消耗
空气,转移
电子
- D、 给该锂-空气电池充电时,金属锂接直流电源正极
根据下列图示所得出的结论错误的是( )
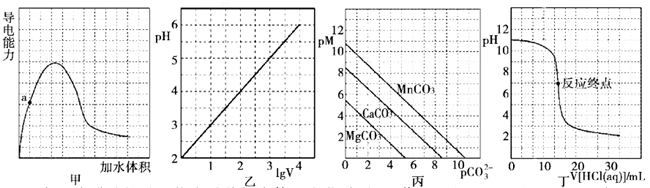
- A、 图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的
试纸测量a点的
,则测量结果可能偏小
- B、 图乙表示
的盐酸溶液加水稀释至
随
的变化关系图
- C、 图丙表示一定温度下三种碳酸盐
的沉淀溶解平衡曲线图
,则有
、
、
的
依次减小
- D、 图丁表示
盐酸滴定
溶液的滴定曲线

