选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项是符合题目要求的。
生产、生活中蕴含了丰富的化学知识,下列有关说法正确的是( )
- A、 氮氧化物的大量排放,会导致光化学烟雾、酸雨和温室效应等环境问题
- B、 500米口径球面射电望远镜被誉为“中国天眼”,其“眼眶”是钢铁结成的圈梁,属于新型纯金属材料
- C、 抗新冠疫情过程中,公共场所常用“84消毒液”消毒处理,该物质的有效成分是次氯酸钙
- D、 水煤气合成甲醇等含氧有机物及液态烃的过程属于煤的液化,实现了煤的综合利用
下列有关化学用语表示正确的是( )
- A、 次氯酸的结构式:H-Cl-O
- B、 CaO2 的电子式:
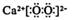
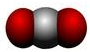
- C、 CO2分子的比例模型:
- D、 乙醇的分子式:CH3CH2OH
某有机物分子结构简式如图,下列有关说法错误的是( )

- A、 1mol 该物质可与7 mol H2发生加成反应
- B、 结构中含氧官能团有3种(不考虑醇与酚的区别)
- C、 分子中能与NaHCO3反应的官能团只有-COOH
- D、 能够使酸性高锰酸钾溶液褪色
下列关于物质的制备、生产的说法正确的是( )
- A、 工业制取金属铝:电解熔融Al2O3
- B、 实验室制取NH3:可用无水CaCl2干燥
- C、 用镁粉和空气反应制备Mg3N2
- D、 NaI溶液与浓H2SO4混合制备HI
NA为阿伏加德罗常数的值,下列说法正确的是( )
- A、 1L1 molL CH3COOH溶液中含有NA个CH3COOH分子
- B、 标准状况下,11.2L 臭氧所含质子数为8NA
- C、 0.2 mol NO与0.1 mol O2在密闭容器中充分反应后,容器中含有的氧原子数为0.4NA
- D、 标准状况下,2.24 LCC4中含有的C-Cl 键数为0.4NA
下列有关实验装置和原理能达到实验目的的是( )
| A | B | C | D |
| 测量锌粒和3 mol/L硫酸反应生成H2的体积 | 制备并收集乙酸乙酯 | 加热熔融的纯碱固体 | 制取并收集SO2 |
| | | | |
- A、 A
- B、 B
- C、 C
- D、 D
科学家合成一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期。下列说法正确的是( )
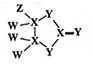
- A、 X的氢化物均为气体
- B、 原子半径:X<Y
- C、 Y与W形成的所有化合物仅含有极性共价键
- D、 ZY2 作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛
下列离子方程式书写正确的是( )
- A、 通入H2S除去废水中的Cu2+等重金属离子:S2-+Cu2+=CuS↓
- B、 向NaAlO2溶液中滴入足量Ca(HCO3)2溶液:AlO2-+ HCO3-+H2O=Al(OH)3↓+CO32-
- C、 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
- D、 工业上用石灰乳制取漂白粉:Cl2+2OH- =ClO-+Cl-+H2O
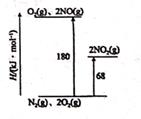
目前认为乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
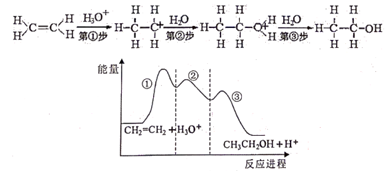
- A、 第①步反应的中间体比第②步反应的中间体稳定
- B、 总反应速率由第①步反应决定
- C、 第③步反应原子利用率为100%
- D、 总反应为吸热反应
将浓盐酸滴入KMnO4溶液中,产生黄绿色气体,溶液的紫红色褪去;向反应后的溶液中加入NaBiO3 , 溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。下列说法错误的是( )
- A、 滴加盐酸时,KMnO4 是氧化剂,Cl2是氧化产物
- B、 此实验条件下,还原性:Cl->Mn2+>Bi3+
- C、 若有0.2 mol NaBiO3参加了反应,则整个过程转移电子为0.8NA
- D、 已知Bi为第VA族元素,上述实验说明Bi具有较强的非金属性
选择题:本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或两个选项符合题 目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
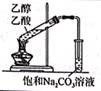
实验室分离Fe3+和Al3+的流程如图:

已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]- , 该配离子在乙醚(El2O, 沸点34.6℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
- A、 酸化后,铁元素在溶液中主要以[FeCl4]形式存在
- B、 萃取分液时,有机层从分液漏斗上口倒出
- C、 反萃取后,铁元素在溶液中主要以Fe3+形式存在
- D、 蒸馏时,用酒精灯直接加热蒸馏烧瓶以加快蒸馏速度