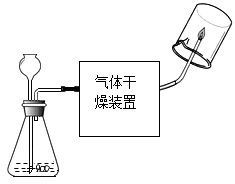
单选题
下列变化属于化学变化的是( )
- A、 食物腐败
- B、 西瓜榨汁
- C、 瓷碗破碎
- D、 湿衣晾干
下列不属于新能源的是( )
- A、 地热能
- B、 太阳能
- C、 石油
- D、 风能
下列食物中富含蛋白质的是( )
- A、 土豆

- B、 菠菜

- C、 面包

- D、 鸡蛋

地壳中含量最多的金属元素是()
- A、 氧
- B、 硅
- C、 铝
- D、 铁
下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )
- A、 木炭
- B、 铁丝
- C、 蜡烛
- D、 红磷
氢氧化钙可用于改良酸性土壤,其俗称是( )
- A、 火碱
- B、 熟石灰
- C、 烧碱
- D、 纯碱
为了防止骨质疏松,人体必须摄入的元素是( )
- A、 钙
- B、 铁
- C、 锌
- D、 碘
下列物质放入水中,能形成溶液的是( )
- A、 食盐
- B、 面粉
- C、 牛奶
- D、 花生油
下列材料中,属于有机合成材料的是( )
- A、 棉花
- B、 木材
- C、 羊毛
- D、 塑料
下列实验操作中正确的是( )
- A、 氧气验满

- B、 取少量液体

- C、 点燃酒精灯

- D、 稀释浓硫酸

下列物质pH范围如下,其中酸性最强的是( )
- A、 柠檬汁(2.0~3.0)
- B、 西瓜汁(5.0~6.0)
- C、 胡萝卜汁(6.0~7.0)
- D、 鸡蛋清(7.6~8.0)
表示“两个氢分子”的是( )
- A、 H2
- B、 H2O
- C、 2H2
- D、 2H
C919客机部分机身采用了铝锂合金,铝元素与锂元素的本质区别是( )
- A、 相对原子质量不同
- B、 中子数不同
- C、 最外层电子数不同
- D、 质子数不同
某些食品需要充气防腐。下列气体最宜充入的是( )
- A、 氢气
- B、 氧气
- C、 氮气
- D、 空气
鉴别空气、氧气和二氧化碳三瓶气体的方法是( )
- A、 观察气体颜色
- B、 插入燃着的木条
- C、 闻气体的气味
- D、 倒入澄清石灰水
野炊时,小明发现木柴火焰很小,将木柴架空后火焰变大,架空的目的是( )
- A、 便于观察火焰的大小
- B、 升高木柴的温度
- C、 降低木柴的着火点
- D、 增大木柴与空气的接触面积
北斗导航卫星系统采用铷原子钟提供精确时间,如图为铷在元素周期表中的相关信息。下列说法正确的是( )

- A、 铷属于非金属元素
- B、 铷原子中的电子数为37
- C、 铷原子中的中子数为37
- D、 铷的相对原子质量是85.47g
6000L氧气在加压的情况下可装入容积为40L的钢瓶中,是因为气体分子( )
- A、 质量变小
- B、 间隔变小
- C、 体积变小
- D、 个数变少
下表中的物质、化学式及用途三者对应关系错误的是( )
| 选项 | 物质 | 化学式 | 用途 |
| A | 活性炭 | C | 可作吸附剂 |
| B | 干冰 | H2O | 可作制冷剂 |
| C | 甲烷 | CH4 | 可作燃料 |
| D | 小苏打 | NaHCO3 | 可治疗胃酸过多症 |
- A、 A
- B、 B
- C、 C
- D、 D
石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的化学方程式为CaCN2+3H2O=CaCO3+2X,则x化学式为( )
- A、 NO
- B、 N2
- C、 CO2
- D、 NH3
粽子的香味源于粽叶的主要成分——对乙烯基苯酚(化学式为C8H8O)。下列说法错误的是( )
- A、 对乙烯基苯酚属于化合物
- B、 对乙烯基苯酚由3 种元素组成
- C、 对乙烯基苯酚中碳元素的质量分数最大
- D、 对乙烯基苯酚由8 个碳原子、8 个氢原子、1 个氧原子构成
下列方法能达到除杂目的的是( )
| 选项 | 物质(括号内为杂质) | 方法 |
| A | 二氧化碳(一氧化碳) | 点燃混合气体 |
| B | 铜粉(碳粉) | 在空气中灼烧固体混合物 |
| C | 氧气(水蒸气) | 将混合气体通过浓硫酸 |
| D | 氯化钠(氢氧化钠) | 加水溶解,过滤 |
- A、 A
- B、 B
- C、 C
- D、 D
常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是()

- A、 实验1后,甲、乙中溶液的溶质质量分数相等
- B、 实验2后,乙中比甲中氯化钠的溶解度大
- C、 实验2后,甲中溶液为氯化钠的不饱和溶液
- D、 实验2后,甲、乙中溶液所含溶质质量相等
汽车尾气处理过程中发生反应的微观示意图如下,下列说法正确的是( )
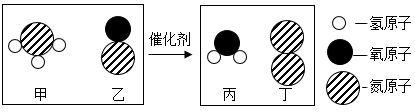
- A、 1个甲分子中有3个原子
- B、 该化学反应前后分子的个数不变
- C、 属于氧化物的物质有3种
- D、 参加反应的甲和乙的质量比为17:45
用下列对比实验探究碱的性质,下列说法错误的是( )

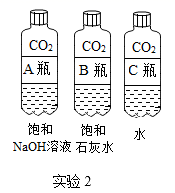
- A、 实验1的现象说明氢氧化钠需密封保存
- B、 实验2中软塑料瓶变瘪的程度为A>B>C
- C、 只能通过对比A,C瓶的现象证明CO2与氢氧化钠反应
- D、 饱和氢氧化钠溶液比饱和石灰水吸收二氧化碳的效果好






 B溶解
B溶解  C蒸发
C蒸发  D过滤
D过滤  E量取
E量取