单选题
在5.6g铁粉中,先逐滴加入一定量的Cu(NO3)2溶液, 充分反应后再逐滴加入AgNO3溶液,剩余固体质量与所加溶液总质量的关系如图所示。下列说法正确的是( )
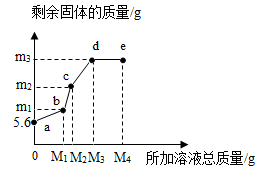
- A、 所加溶液质量为M1g时,生成Cu的质量为m1g
- B、 bc段发生的是Cu和AgNO3溶液的反应
- C、 m3的值为21.6
- D、 e点溶液中不含Cu(NO3)2
镁、锌、铁的混合物50克与足量的稀硫酸反应得到混合溶液,蒸发后得到218克固体(已换算成无水硫酸盐)。则反应产生氢气的质量是( )
- A、 2克
- B、 3克
- C、 3.5克
- D、 4.5克
某只含铁、氧两种元素的样品A,高温时与足量的CO充分反应,生成的气体被足量澄清石灰水吸收,测得沉淀的质量与原样品A质量相等,如果A中只含两种物质,则A中一定含有( )
- A、 FeO
- B、 Fe2O3
- C、 Fe
- D、 Fe3O4
一定温度下,向ag FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。下列叙述错误的是( )

- A、 Fe(OH)3沉淀完全时消耗NaOH的质量为ng
- B、 P点对应的溶液中NaOH达到饱和状态
- C、 m=c-a
- D、 生成Fe(OH)3的质量为(n-b+a)g
将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
| 物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
下列判断正确的是 ( )
- A、 表中a的值为3.8
- B、 X一定是该反应的催化剂
- C、 X可能含有氢元素
- D、 若起始时氧气的质量是14.4g,则无X生成
把6g碳在24g氧气中充分燃烧,生成二氧化碳的质量是( )
- A、 30g
- B、 22g
- C、 32g
- D、 44g
将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
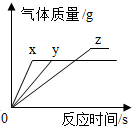
- A、 图线 Y 表示镁的反应情况
- B、 镁一定过量
- C、 锌一定过量
- D、 镁消耗稀盐酸的质量最大 试题卷 Ⅱ
将20克10%的盐酸与20克10%的氢氧化钠溶液混合,下列物质中能跟该混合溶液发生反应的是( )
- A、 氯化钡
- B、 氯化铁
- C、 二氧化碳
- D、 氢氧化钾
在托盘天平的两端各放一只烧杯,在两烧杯中分别注入相同质量分数、等质量且足量的稀硫酸,调节至平衡。现向左边烧杯投入20.8克10%的氯化钡溶液,向右边烧杯投入21.2克铁与铜的混合物,充分反应后,天平重新平衡,则混合物中铁的质量为( )
- A、 5.6克
- B、 11.2克
- C、 8.4克
- D、 14克
将10g溶质质量分数为a%的氢氧化钠溶液与10g溶质质量分数为a%的硫酸溶液混合后,所得溶液的pH是( )
- A、 小于7
- B、 等于7
- C、 大于7
- D、 不确定
在化学反应A+B=C+D中,若有5克的A与10克的B恰好完全反应,生成1克的C和一定质量的D,,小明做实验前发现容器中只有5克B,则最多生成的D的质量为( )
- A、 5克
- B、 7克
- C、 13克
- D、 8克
过氧化氢的水溶液俗称双氧水,在放置过程中会缓慢分解。某 100g 30%的双氧水放置一段时间后,经实验测定其溶质质量分数变为 25%,则分解掉的过氧化氢的质量是( )
- A、 6.56g
- B、 5.67g
- C、 5.3g
- D、 5g
充分反应27g的铝与50g的氧气后得到固体物质的质量为( )
- A、 51g
- B、 77g
- C、 75g
- D、 65g
有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是( )
- A、 0.2g
- B、 0.6g
- C、 0.8g
- D、 0.9g
13.5gCuCl2样品,当与足量的AgNO3溶液反应后,得到29gAgCl沉淀,则样品中不可能混有的盐是( )
- A、 BaCl2
- B、 CaCl2
- C、 AlCl3
- D、 NaCl