单选题
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
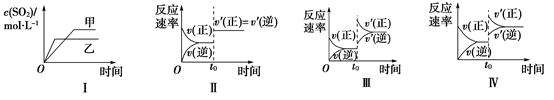
- A、 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
- B、 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
- C、 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
- D、 图Ⅳ表示t0时升温对反应速率的影响
已知反应CO(g)+H2O(g)  CO2 (g)+H2 (g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2 (g)+H2 (g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
- A、 升高温度,K增大
- B、 减小压强,n(CO2)增加
- C、 更换高效催化剂, CO转化率增大
- D、 充入一定量的氮气,n(H2)不变
一定温度的恒容密闭容器中进行如下可逆反应A(s)+2B(g)  2C(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
2C(g),下列叙述中,能说明反应已达到化学平衡状态的是( )
- A、 A,B,C的分子数之比为1:2:2
- B、 混合气体的密度不再变化
- C、 容器内的压强不再变化
- D、 单位时间内生成amolA,同时消耗2amolC
5mL 0.1mol/L的KI溶液与1mL 0.1mol/L的FeCl3溶液发生反应:
2Fe3+(aq)+2I-(aq) ![]() 2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )
2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )
- A、 该反应的平衡常数K=c2(Fe2+)/c(Fe3+)•c(I2)
- B、 经CCl4多次萃取后,向水溶液中滴入KSCN溶液,呈血红色,说明该反应存在限度
- C、 加入碘化钾固体,平衡正向移动
- D、 当溶液的颜色不再发生变化时,可以判断该反应已经达到平衡状态
研究反应  的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )

- A、 比较实验①④不能得出:升高温度,化学反应速率加快
- B、 比较实验①②得出:増大反应物浓度,化学反应速率加快
- C、 若实验②③只有一个条件不同,则实验③使用了催化剂
- D、 在0~10 min之向,实验②的平均速率v(Y)=0.01mol/(L·min)
一定温度下,在体积为2L的恒容密闭容器中发生反应:
反应过程中的部分数据如下表所示:
| n/mol t/min | n(A) | n(B) | n(C) |
| 0 | 4.0 | 1.0 | 0 |
| 2 | 0.6 | 0.2 | |
| 4 | 0.4 | ||
| 6 | 2.8 | 0.3 |
下列说法正确的是( )
- A、
min时,该反应可能已达到平衡
- B、 反应开始后,不管t取何值,A与B的转化率均不可能相等
- C、 反应达到平衡状态时,用B表示的平均反应速率为0.05
- D、
min时,反应放出的热量为0.6QkJ
在  时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )
时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )
| 物质 | X | Y | Z |
| 起始浓度/( | 0.1 | 0.2 | 0 |
| 平衡浓度/( | 0.05 | 0.1 | 0.1 |
- A、 反应达到平衡时,Y的转化率为50%
- B、 反应可表示为
,平衡常数为200
- C、 其他条件不变时,增大压强可使平衡向右移动
- D、 若升温后Z的平衡浓度减小,则该反应为放热反应
在密闭容器中充入一定量的NO2 , 发生反应2NO2(g)  N2O4(g)ΔH=﹣57 kJ•mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJ•mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )

- A、 a、c两点的反应速率:a>c
- B、 a、b两点的转化率:a<b
- C、 a、c两点气体的颜色:a深,c浅
- D、 由a点到b点,可以用加热的方法
工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g)  Si(s)+4HCl(g) ΔH=+QkJ·mol-1(Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
Si(s)+4HCl(g) ΔH=+QkJ·mol-1(Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( )
- A、 反应过程中,若增大压强能提高SiCl4的转化率
- B、 若反应开始时SiCl4为1mol,则在平衡时,吸收热量为QkJ
- C、 将反应的温度由T1升高至T2 , 则对应温度下的平衡常数K1>K2
- D、 当反应吸收热量为0.25QkJ时,生成的HCl恰好与1 mol NaOH反应
化学反应Ⅰ、Ⅱ、Ⅲ在不同温度时达到平衡,其平衡常数如下表:
| 编号 | 化学方程式 | 温度 | |
| | | ||
| Ⅰ | | 1.47 | 2.15 |
| Ⅱ | | 1.62 | b |
| Ⅲ | | a | 1.68 |
根据以上信息判断,下列结论正确的是( )
- A、 将铁粉磨细可以使平衡Ⅰ向右移动
- B、 反应Ⅱ、Ⅲ均为放热反应
- C、 升高温度,反应Ⅲ平衡向正反应方向移动
- D、
一定条件下,在体积不变的绝热密闭容器中,发生反应  。能表示该反应一定达到化学平衡状态的是( )
。能表示该反应一定达到化学平衡状态的是( )
- A、 单位时间内消耗
,同时生成
- B、 混合气体总物质的量不再发生变化
- C、 Y和Z的物质的量浓度相等
- D、 容器中的压强不再发生变化
在某一密闭容器中,若反应  达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )
达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )
- A、 容器内气体密度减小
- B、 平衡向正反应方向移动
- C、 二氧化氮的转化率增大
- D、 四氧化二氮的体积分数增大
乙烯的产量是衡量一个国家石油化工发展水平的重要标志。一定条件下CO2和H2合成乙烯的反应为2CO2(g) + 6H2(g)= 4H2O(g) + CH2=CH2(g) ΔH= a kJ∙mol-1。向恒容密闭容器中充入体积比为1:3的CO2和H2 , 测得不同温度下CO2的平衡转化率及催化剂的催化效率如图所示。下列有关说法正确的是( )
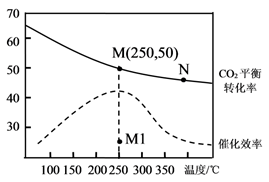
- A、 M点的平衡常数比N点的小
- B、 温度低于250℃时,乙烯的产率随温度升高而增大
- C、 保持N点温度不变,向容器中再充入一定量的H2 , CO2的转化率可能会增大到50%
- D、 其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1点
在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列各项能作为判断该反应达到化学平衡状态的依据的是( )
- A、 容器内的压强保持不变
- B、 容器内混合气体的密度保持不变
- C、 混合气体中
和
的物质的量浓度之比为1∶3
- D、 单位时间内每断裂3molH—H键,同时形成6molN—H键
反应N2(g)+3H2(g)  2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是:( )
2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是:( )
- A、 容器内的温度不再变化
- B、 相同时间内断开H-H键数目和生成N-H键数目相等
- C、 容器内的压强不再变化
- D、 容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶2
一定压强下,向10 L密闭容器中充入1molS2Cl2(g)和1 molCl2 , 发生反应:S2Cl2(g)+Cl2(g)⇌2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( )

- A、 A,B,C,D四点对应状态下,达到平衡状态的是B,D
- B、 正反应的活化能大于逆反应的活化能
- C、 达到平衡后再加热,平衡向逆反应方向移动
- D、 在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变
在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g) ∆H, 反应过程中持续升高温度,相同时间内测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

- A、 升高温度,平衡常数增大
- B、 M点时,Y的转化率最大
- C、 平衡后充入Z,正反应速率减小
- D、 W,M两点Y的正反应速率不同
生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g)  Hb(O2)。下列说法正确的是( )
Hb(O2)。下列说法正确的是( )
- A、 体温升高,O2与Hb结合更快,反应的平衡常数不变
- B、 吸入新鲜空气,平衡逆向移动
- C、 CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大
- D、 高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g)
Hb(O2)+CO(g)右移

