单选题
为检验溶液里的某种离子,进行下列实验,其中结论正确的是( )
- A、 溶液中加 AgNO3 溶液有白色沉淀生成,再加入稀盐酸沉淀不溶解,溶液一定含 Cl-
- B、 先滴加 KSCN 溶液不显红色,再滴加氯水后显红色证明某溶液中含有 Fe2-
- C、 某溶液进行焰色反应为黄色,则该溶液一定含有 Na+ ,一定没有K+
- D、 溶液中加入稀 HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含 CO32-
每天用“84”消毒液(NaClO溶液)可用于消毒,下列说法正确的是( )
- A、 NaClO溶液的消毒原理是生成Cl2
- B、 NaClO暴露在空气中变质形成HClO
- C、 NaClO溶液漂白原理与活性炭相同
- D、 “84”消毒液可与“洁厕灵” (HCl)共同使用
化学材料的使用对人类生活质量的提高和科技的发展有重要作用,下列说法正确的是( )
- A、 生铁的含碳量为0.03%~2%
- B、 “天和”核心舱电推进系统中的霍尔推力器腔体,使用的氮化硼陶瓷基复合材料属于无机非金属材料
- C、 T-碳是一种新型三维碳结构晶体,与C60互为同位素
- D、 “北斗三号”导航卫星使用的太阳能电池材料-砷化镓属于金属材料
如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是( )

- A、 浓H2SO4
- B、 浓NaOH溶液
- C、 饱和NaCl溶液
- D、 石灰乳
下列既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是( )
- A、 FeCl2
- B、 NaCl
- C、 FeCl3
- D、 CuCl2
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
- A、 新制氯水显淡黄绿色(Cl2)
- B、 将NaHCO3固体加入新制氯水中,有无色气泡产生(HClO)
- C、 向新制氯水中滴加石蕊溶液,溶液先变红后褪色(H+、HClO)
- D、 滴加AgNO3溶液有白色沉淀产生(Cl-)
下列说法错误的是( )
- A、 O2和O3互为同素异形体
- B、 KBr→Br2需加入还原剂才能实现
- C、 钠的焰色试验是物理变化
- D、 ClO2可用于自来水消毒
2021年7月25日,“泉州:宋元中国的世界海洋商贸中心”正式列入《世界遗产名录》。古代丝绸、茶叶、瓷器、铜铁器等从泉州运往世界各地。下列说法错误的是( )
- A、 可用灼烧的方法鉴别丝绸和化学纤维制品
- B、 泡茶时茶香四溢,体现了分子是运动的
- C、 烧制陶瓷的过程中不涉及化学变化
- D、 从赤铁矿冶炼铁的过程中一定有氧化还原反应发生
“84”消毒液(NaClO溶液)可用于消毒,下列说法正确的是( )
- A、 可用pH试纸测定该消毒液的pH
- B、 NaClO暴露在空气中变质形成HClO
- C、 NaClO溶液漂白原理与活性炭相同
- D、 “84”消毒液与“洁厕灵"(HCl)混用,效果更佳.
下列关于氯气、液氯、新制氯水和久置氯水的叙述正确的是( )
- A、 久置的氯水相当于盐酸
- B、 液氯和新制氯水均是混合物
- C、 常温下,氯水和液氯均可用钢罐存放
- D、 氯气有强氧化性、氯水无氧化性
10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭,在酒泉卫星发射中心点火升空。长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法错误的是( )
- A、 煤油和液氢都是可再生能源
- B、 火箭燃料燃烧时,化学能转化为热能
- C、 运载火箭主体结构件框所用高精尖铝合金材料具有质量轻、强度高等优点
- D、 液氢属于纯净物,煤油属于混合物
关于合成氨工业的说法错误的是( )
- A、 合成氨工业采用循环操作,主要是为了提高氮气和氢气的利用率
- B、 工业上一般选择400-500℃的主要原因是让铁触媒的活性大,反应速率快
- C、 从合成氨的原理出发,增大压强既有利于加快速率又有利于平衡右移,但压强增大设备成本大幅度提升,所以实际工业中往往采用常压
- D、 为了防止催化剂“中毒”,原料气需要经过净化
部分含硫物质中的硫元素的价态及该物质的类别关系如图所示。下列说法错误的是( )

- A、
微溶于酒精,易溶于
- B、 向
的溶液中通入
,可产生淡黄色沉淀
- C、 滴加
溶液,即可鉴别
、
两种溶液
- D、 在一定条件下,可实现
的转化
2020年12月17日,嫦娥五号探测器携带着珍贵的月球“土特产”——月壤成功返回,研究表明月壤包含微细的矿物颗粒、岩石碎屑和玻璃质微粒等,主要由氧、硅、铝、铁、镁钙、钠、钾、钛等元素构成。下列相关化学用语正确的是( )
- A、
和
是氧的两种不同的同素异形体
- B、
核外有m个电子、n个中子,X原子符号为
- C、 钾原子的原子结构示意图为:
- D、 一种月壤辉长岩成分为
,用氧化物的形式表示其组成为
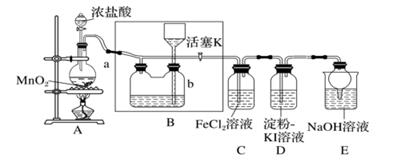
利用如图装置进行Cl2制备及其化学性质的探究。下列说法错误的是( )

- A、 拉动a或b的活塞,可检查装置气密性
- B、 c中反应的氧化产物与还原产物的质量比为6:1
- C、 c中产生Cl2后,d褪色的原因是次氯酸具有漂白性
- D、 性质实验结束后,加入b中溶液除去多余的Cl2 , 溶液由红色变为无色
下列反应的离子方程式书写正确的是( )
- A、 金属铝溶于氢氧化钠溶液:Al+2OH =AlO+H2
- B、 用氢氧化钠溶液吸收少量二氧化碳:OH + CO2 =HCO3
- C、 向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液: Ca2+ + HCO+ OH= CaCO3
+H2O
- D、 向硫酸铁酸性溶液中通入足量硫化氢: 2Fe3++S2-=2Fe2++S
甲、乙、丙三种不同的物质中均含有同一种元素,反应④为置换反应,往乙溶液中滴加KSCN 溶液,乙溶液变为红色。它们之间的转化关系如图所示(部分反应物及生成物已略去)。下列说法 错误的是( )

- A、 反应① 、②可能为化合反应
- B、 反应④的另一反应物可以为某种盐的水溶液
- C、 甲为金属单质,也可能为非金属单质
- D、 若甲为金属单质,甲、乙、丙中的相同元素化合价不同

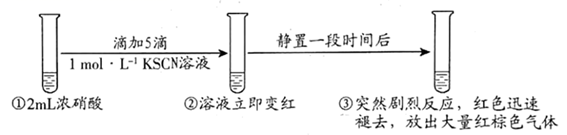
 下列说法错误的是( )
下列说法错误的是( )