单选题
化学与生产、生活密切相关,下列说法正确的是( )
- A、 离子交换膜有多种类型,如氯碱工业中使用的是阴离子交换膜
- B、 月饼包装袋中的双吸剂和一次性保暖贴的主要成分都含有铁粉
- C、 神舟十三号载人飞船中的太阳能电池和储能电池均可将化学能转化为电能
- D、 “海水淡化”可以解决淡水供应危机,向海水中加入净水剂明矾可实现海水淡化
下列关于化学用语的说法正确的是( )
- A、 Cr原子核外电子有24种空间运动状态
- B、 Fe2+的价电子轨道表示式:

- C、 醋酸的电离方程式:CH3COOH+H2O
CH3COO-+H3O+
- D、 表示氢气摩尔燃烧焓的热化学方程式:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
NA为阿伏加德罗常数的值,下列说法正确的是( )
- A、 18gH218O含有的中子数为10NA
- B、 粗铜精炼中阳极减少64g时,外电路中转移电子数为2NA
- C、 1LpH=13的Ba(OH)2溶液中Ba2+数目为0.1NA
- D、 常温下,向1L0.1mol·L-1氯化铵溶液中加入氨水至中性,则溶液中NH
的数目为0.1NA
下列描述不正确的是( )
- A、 铁制品上使用铜配件,在接触处铁更易生锈
- B、 以KOH溶液为离子导体的CH4-O2燃料电池,工作一段时间后溶液的pH减小
- C、 先将足量二氧化碳通入饱和食盐水,再通入氨气降温可析出碳酸氢钠固体
- D、 熔融状态下AlCl3不导电而AlF3导电,可以说明电负性F>Cl
下列现象可以用勒夏特列原理来解释的是( )
- A、 硫酸氢钠溶液pH小于7
- B、 使用合适的催化剂可以提高合成氨的产量
- C、 二氧化氮和四氧化二氮的平衡体系中,容器体积减小一半颜色加深
- D、 人体血液中存在的H2CO3-NaHCO3体系能起到稳定血液pH的作用
下列相关方程式书写正确的是( )
- A、 铁吸氧腐蚀时负极反应式为:Fe-3e-=Fe3+
- B、 将碳酸镁在沸水中长时间加热:MgCO3+H2O
Mg(OH)2+CO2↑
- C、 泡沫灭火器灭火原理:2Al3++3CO
+3H2O=2Al(OH)3↓+3CO2↑
- D、 1molN2与3molH2充分反应放出的热量为akJ,则其热化学方程式为:N2(g)+3H2(g)
2NH3(g) ∆H=-akJ·mol-1
根据下列图示所得出的结论正确的是( )

- A、 图甲表示反应X(g)+3Y(g)
2Z(g)的能量变化,若更换高效催化剂,则E3不变
- B、 图乙表示密闭容器中CH4(g)+H2O(g)
CO(g)+3H2(g)到达平衡时,CH4的转化率与压强、温度的变化关系曲线,则p1<p2
- C、 图丙表示一定温度下,冰醋酸加水稀释过程中溶液导电能力的变化,则b点时醋酸电离程度最大
- D、 图丁表示t℃时,Ag2CrO4的沉淀溶解平衡曲线,向Ag2CrO4的悬浊液中加入K2CrO4可使溶液由Y点变到X点
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是( )

- A、 图1中可以通过测定相同状况下反应产生的气体体积及反应时间比较反应速率的大小
- B、 用图1装置进行实验时,关闭A处活塞,将注射器活塞向外拉,松开后活塞复原说明装置气密性良好
- C、 图2实验可通过观察产生气泡的快慢来比较反应速率的大小
- D、 若图2所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解反应的催化效果好
某温度下,向10mL0.1mol·L-1Na2S溶液中滴加0.1mol·L-1CuCl2溶液,S2-浓度与CuCl2溶液体积的关系如图所示。已知:pC=-lgc(S2-),已知:Ksp(CuS)=1.0×10-36 , Ksp(FeS)=6.0×10-18。下列说法不正确的是( )

- A、 水的电离程度:n
- B、 图像中n点坐标:(10,18)
- C、 a点溶液:c(OH-)>2c(HS-)+2c(H2S)
- D、 若用FeCl2溶液替代CuCl2溶液,则n点向d点方向移动
X、Y、Z、W为原子序数依次增大的短周期主族元素,Y、Z均可与X形成含10个电子的分子,且第一电离能Y>Z。W原子电离能:I1=500、I2=4600、I3=6900、I4=9500、I5…,下列说法不正确的是( )
- A、 Y、Z还均可与X形成含18个电子的分子
- B、 这四种元素位于三个不同周期
- C、 简单离子半径:Y>Z>W
- D、 电负性:Y>Z>X
用黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量FeO、Fe2O3)生产晶体Cu(NO3)2·3H2O的流程如图所示,下列说法正确的是( )
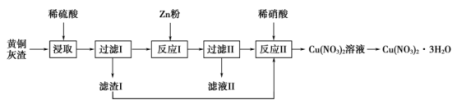
- A、 “浸取”时使用浓硫酸可加快反应速率
- B、 滤液II中一定含Zn2+、Fe2+、SO
离子
- C、 若制得纯度较高的Cu(NO3)2·3H2O,反应中所加Zn需过量
- D、 将Cu(NO3)2溶液蒸发浓缩、冷却结晶、过滤得到Cu(NO3)2·3H2O





