单选题
反应  ,经一段时间后,
,经一段时间后,  的浓度增加了0.8mo/L,在这段时间内用
的浓度增加了0.8mo/L,在这段时间内用  表示的反应速率为
表示的反应速率为  ,则这段时间为( )
,则这段时间为( )
- A、 0.1s
- B、 2.5s
- C、 5s
- D、 10s
在恒温、体积为2L的密闭容器中进行反应:2A(g)  3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为( )
3B(g)+C(g),若反应物在前20s由3mol降为1.8mol,则前20s的平均反应速度为( )
- A、υ(B)=0.045mol/(L·s)
- B、υ(B)=0.03mol/(L·s)
- C、υ(C)=0.03mol/(L·s)
- D、υ(C)=0.06mol/(L·s)
某温度下,化学反应 A = B + C中反应物A的浓度在5s内从2.0 mol•L-1减少到1.0 mol•L-1。在这段时间内,用A的浓度变化表示的平均反应速率为( )
- A、 0.4 mol•L-1
- B、 0.2 mol•L-1
- C、 0.4 mol•L-1•s-1
- D、 0.2 mol•L-1•s-1
对于可逆反应A(g)+3B(s) 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
- A、 v(A)=0.3 mol·L-1·s-1
- B、 v(B)=1.2 mol·L-1·s-1
- C、 v(D)=0.8 mol·L-1·min-1
- D、 v(C)=0.5 mol·L-1·s-1
在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
- A、 v(A)=0.5 mol•L-1•s-1
- B、 v(B)=0.3 mol•L-1•s-1
- C、 v(C)=0.8 mol•L-1•s-1
- D、 v(D)=30 mol•L-1•min-1
对反应A+B=AB来说,常温下按以下情况进行反应:
①20 mL溶液中含A、B各0.01 mol
②50 mL溶液中含A、B各0.05 mol
③0.1 mol·L-1的A、B溶液各10 mL
④0.5 mol·L-1的A、B溶液各50 mL
四者反应速率的大小关系是( )
- A、 ②>①>④>③
- B、 ④>③>②>①
- C、 ①>②>④>③
- D、 ①>②>③>④
下列关于有效碰撞理论与影响速率因素之间关系正确的是( )
- A、 升高温度,可以提高活化分子的能量,会减慢反应速率
- B、 增大反应物浓度,可以提高活化分子百分数,从而提高反应速率
- C、 一般使用催化剂可降低反应的活化能,增大活化分子百分数,从而提高反应物转化率
- D、 对于气体反应来说,压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率
下列说法不一定正确的是( )
- A、 增大反应物浓度能增大单位体积内活化分子总数,化学反应速率增大
- B、 增大压强能增大活化分子百分数,化学反应速率增大
- C、 升高温度能增大活化分子百分数,化学反应速率增大
- D、 加入合适催化剂能增大活化分子百分数,化学反应速率增大
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度②升高温度③增大压强④加入催化剂
- A、 ①②
- B、 ②③
- C、 ②④
- D、 ③④
下列说法正确的有几项( )
①活化分子间的碰撞一定能发生化学反应
②普通分子不会发生碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能加快反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应的实质是活化分子有合适取向时的有效碰撞
- A、 1项
- B、 2项
- C、 3项
- D、 4项
已知X(g)+Y(g)⇌Z(g)+M(g)+N(s) △H<0,如图所示,曲线a表示反应进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应的过程按b曲线进行,可采取的措施是( )

- A、 加催化剂
- B、 加大X的投入量
- C、 升高温度
- D、 减少压强
将Ag块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将Bg粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是(已知A>B)( )
- A、

- B、

- C、

- D、

通过缩小反应容器体积而增大压强对下列反应的速率无影响的是( )
- A、 CO2(g)+Ca(OH)2=CaCO3↓+H2O
- B、 H2(g)+I2(g)
 2HI(g)
2HI(g) - C、 NaCl+AgNO3=AgCl↓+NaNO3
- D、 N2(g)+3H2(g)
 2NH3(g)
2NH3(g)
实验室利用如下方案探究影响化学反应速率的因素。下列有关说法错误的是( )
实验编号 | 温度 | 酸性KMnO4溶液 | H2C2O4溶液 |
① | 25℃ | 0.01 | 0.1 |
② | 25℃ | 0.01 | 0.2 |
③ | 25℃ | 0.01 | 0.1 |
④ | 25℃ | 1 | 0.2 |
- A、 实验④反应速率最快,褪色时间最短
- B、 实验①②探究的是浓度对化学反应速率的影响
- C、 如果起始时向①中加入MnSO4固体,反应速率加快
- D、 该反应的离子方程式为
H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
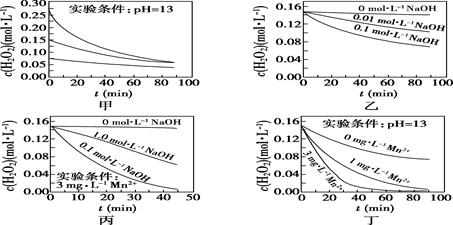
- A、 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
- B、 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
- C、 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
- D、 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
下列图示装置不能达到实验目的的是( )

- A、 图1:验证温度对化学平衡的影响
- B、 图2:测定锌与稀硫酸的反应速率
- C、 图3:验证FeCl3溶液对H2O2分解有催化作用
- D、 图4:研究浓度对反应速率的影响
HCOOH催化释放氢,在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图所示,下列叙述不正确的是( )

- A、 HCOOD催化释氢反应除生成CO2外,还生成HD
- B、 催化过程中涉及极性共价键的断裂和形成
- C、 其他条件不变时,以HCOOK溶液代替HCOOH催化释氢,可加快生成氢气的速率
- D、 使用催化剂可有效提高反应物的平衡转化率
1,3-丁二烯在环己烷溶液中与溴发生加成反应时,会生成两种产物,其反应机理如下:

下列说法不正确的是( )
- A、 两种加成产物相比,1,4加成产物更稳定
- B、 两种反应历程相比,1,2加成反应速率更快
- C、 增大溴的浓度,可提高1,3-丁二烯的转化率
- D、 升高温度,1,4加成正反应速率的增大,逆反应速率减小
 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
