单选题
从科技前沿到日常生活,化学无处不在。下列说法错误的是
- A、 我国首次在实验室实现了二氧化碳到淀粉的合成,生物酶催化剂的使用改变了反应历程
- B、 神舟十三号顺利升空时,火箭尾部喷射的气体呈红棕色是因为部分助燃剂
转化为
- C、 水是21世纪最宝贵的资源之一,明矾与高铁酸钾均可作水处理剂,两者处理水的原理相同
- D、 2022年北京冬奥会将采用石墨烯材料制造户外保暖穿戴设备,石墨烯中碳原子为
杂化
- A、
、
和
中C、N杂化方式均相同
- B、
和
的空间结构分别为正四面体形、三角锥形
- C、
、
和
均为极性分子
- D、 沸点:
2021年10月,神舟十三号载人飞船成功发射。载人飞船中通过如下过程实现O2再生:
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH1=-252.9 kJ·mol-1
②2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6 kJ·mol-1
下列说法错误的是
- A、 H2的燃烧热ΔH = -285.8 kJ·mol-1
- B、 反应2H2(g)+O2(g)=2H2O(g)的 ΔH<-571.6 kJ·mol-1
- C、 反应2H2(g)+O2(g)=2H2O(l) 常温下能自发进行
- D、 反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的 ΔH=-890.3 kJ·mol-1
下列实验装置能达到目的的是( )

- A、 直接蒸干
溶液获取
晶体
- B、 实验室简易制取少量
- C、 比较浓度对化学反应速率的影响
- D、 验证铁的吸氧腐蚀
合成氨反应的反应历程和能量变化如图所示(*R表示微粒处于吸附状态)。下列说法错误的是
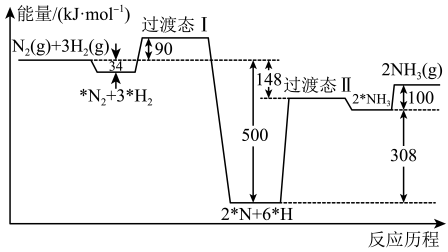
- A、
- B、 决定总反应速率的反应历程为
- C、 升高温度,该反应历程中基元反应的速率均加快
- D、 反应历程中的最低能垒(活化能)为
X、Y为同周期主族元素, Y有8种不同运动状态的电子,二者形成的一种化合物固态时以[XY2]+[XY3]-的形式存在。下列说法错误的是
- A、 Y形成的单质可能是极性分子
- B、 [XY3] -中心原子杂化方式为sp2
- C、 [XY2]+空间结构为直线形
- D、 X、Y形成的简单氢化物稳定性: X> Y
我国科研人员研制出的可充电“ ”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为
”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为 , 其工作原理如图所示。
, 其工作原理如图所示。

已知:生成的和C全部沉积在电极表面。
下列说法正确的是
- A、 MWCNT电极上的电势比钠箔电极上的低
- B、 为增强溶液导电性,电解液可用
溶液
- C、 放电时每消耗4.6gNa,MWCNT电极质量增加6.6g
- D、 充电时阳极反应为

已知:第一电子亲和能是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。
下列说法错误的是
- A、 Ba的第一电离能为
- B、
键能(x)为
- C、 Cl的第一电子亲和能为
- D、
转变成
吸收的能量为177.8kJ
物质的组成与结构决定了物质的性质与变化,结构化学是化学研究的重要领域。下列说法正确的是
- A、 由于氢键的作用,
的稳定性强于
- B、 已知苯酚(
 )具有弱酸性,其
)具有弱酸性,其;水杨酸(
 )第一级电离形成的离子(
)第一级电离形成的离子( )能形成分子内氢键,据此判断,相同温度下电离平衡常数
)能形成分子内氢键,据此判断,相同温度下电离平衡常数 - C、
的几何构型为
型,其中心原子的杂化形式为
杂化
- D、 在基态
原子中,核外存在2对自旋相反的电子,其核外电子有4种运动状态
一种新型可充电钠离子电池的工作原理如图所示。下列说法正确的是( )

- A、 放电时,Mo箔为正极
- B、 充电时,
通过交换膜从右室移向左室
- C、 放电时,外电路中通过0.1mol电子时,左室中生成
- D、 充电时,阴极反应为




