单选题
化学让世界更美好,生活中处处有化学,下列叙述错误的是
- A、 加热能杀死流感病毒是因为蛋白质受热变性
- B、 泡沫灭火器可用于木质材料的起火,也适用于电器起火
- C、 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
- D、 绿色化学要求从源头上消除或减少生产活动对环境的污染
中医药是中华民族的瑰宝,我国科研人员发现中药成分黄苓素能明显抑制新冠病毒的活性。下列说法正确的是
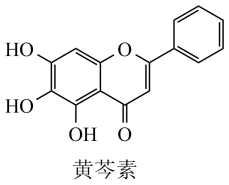
- A、 黄芩素的分子式为C15H12O5
- B、 黄芩素分子中含有五种类型的官能团
- C、 黄芩素分子中所有碳原子不可能共平面
- D、 黄芩素可发生取代反应、加成反应和氧化反应
工业上在催化剂的作用下CO可以合成甲醇,用计算机模拟单个CO分子合成甲醇的反应历程如图。下列说法正确的是。

- A、 反应过程中有极性键的断裂和生成
- B、 反应的决速步骤为III→IV
- C、 使用催化剂降低了反应的
- D、 反应的热化学方程式为
一种新型的电解质的结构如图所示(箭头指向表示共用电子对由W提供),W、X、Y、Z是同周期四种主族元素,Y原子的最外层电子数是X原子次外层电子数的3倍,下列说法错误的是

- A、 该物质中含离子键、极性键和非极性键
- B、 该物质中X原子满足8电子稳定结构
- C、 W的非金属性比Y的弱
- D、 W、X、Y、Z四种元素中,X的原子半径最大
我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH— , 工作原理如图所示,下列说法正确的是

- A、 a膜是阴离子膜,b膜是阳离子膜
- B、 充电时Zn电极反应式为Zn+4OH--2e-=
- C、 放电时多孔Pd纳米片附近pH升高
- D、 当放电时,复合膜层间有1molH2O解离时,正极区溶液增重23g
化学上常用AG表示溶液中的 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.100mol·L-1的HNO2溶液,AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误的是

- A、 随着NaOH溶液的加入,
减小
- B、 25℃时,HNO2的电离常数Ka的数量级为10-6
- C、 b点溶液中存在:2c(H+)-2c(OH-)=c(
)-c(HNO2)
- D、 a、b、c、d、e五点的溶液中,水的电离程度最大的点是d


