选择题
若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )

- A、
与浓硫酸反应,只体现
的酸性
- B、 a处变红,说明
是酸性氧化物
- C、 b或c处褪色,均说明
具有漂白性
- D、 试管底部出现白色固体,说明反应中无
生成
下列说法正确的是( )
- A、 苯酚、乙醇、硫酸铜、氢氧化钠和硫酸铵均能使蛋白质变性
- B、 通过石油的常压分馏可获得石蜡等馏分,常压分馏过程为物理变化
- C、 在分子筛固体酸催化下,苯与乙烯发生取代反应获得苯乙烯
- D、 含氮量高的硝化纤维可作烈性炸药
下列说法不正确的是( )
- A、 灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进行灰化
- B、 用纸层析法分离铁离子和铜离子时,不能将滤纸条上的试样点浸入展开剂中
- C、 将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清
- D、 不能将实验室用剩的金属钠块放回原试剂瓶
名称为“干燥管”的仪器是( )
- A、
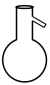
- B、

- C、
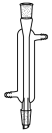
- D、
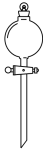
某同学在两个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线:

下列说法正确的的是( )
- A、 图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
- B、 当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为:HCO
+H+=CO2↑+H2O
- C、 根据pH—V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
- D、 Na2CO3和NaHCO3溶液中均满足:c(H2CO3)-c(CO
)=c(OH-)-c(H+)
某兴趣小组为制备1-氯-2-甲基丙烷(沸点69℃),将2-甲基-1-丙醇和POCl3溶于CH2Cl2中,加热回流(伴有HCl气体产生)。反应完全后倒入冰水中分解残余的POCl3 , 分液收集CH2Cl2层,无水MgSO4干燥,过滤、蒸馏后得到目标产物。上述过程中涉及的装置或操作错误的是(夹持及加热装置略)( )
| | | | |
| A. | B. | C. | D. |
- A、 A
- B、 B
- C、 C
- D、 D
进行下列实验操作时,选用仪器正确的是( )
| 提取碘水中的碘 | 量取一定体积的KMnO4溶液 | 熔化NaOH固体 | 浓缩NaCl溶液 |
| | | | |
| A | B | C | D |
- A、 A
- B、 B
- C、 C
- D、 D
用  盐酸滴定
盐酸滴定  溶液,溶液中
溶液,溶液中  、
、  、
、  的分布分数
的分布分数  随pH变化曲线及滴定曲线如图。下列说法正确的是(如
随pH变化曲线及滴定曲线如图。下列说法正确的是(如  分布分数:
分布分数:  )( )
)( )

- A、
的
为
- B、 c点:
- C、 第一次突变,可选酚酞作指示剂
- D、
用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是( )

| 选项 | 气体 | a | b |
| A | | 稀 | |
| B | | | |
| C | | 浓 | 铁片 |
| D | | 浓氨水 | |
- A、 A
- B、 B
- C、 C
- D、 D
一次性鉴别等浓度的  、
、  、
、  三种溶液,下列方法不可行的是( )
三种溶液,下列方法不可行的是( )
- A、 测定
- B、 焰色试验
- C、 滴加
溶液
- D、 滴加饱和
溶液,微热
实验室制备下列气体所选试剂、制备装置及收集方法均正确的是( )

| 气体 | 试剂 | 制备装置 | 收集方法 | |
| A | O2 | KMnO4 | a | d |
| B | H2 | Zn+稀H2SO4 | b | e |
| C | NO | Cu+稀HNO3 | b | c |
| D | CO2 | CaCO3+稀H2SO4 | b | c |
- A、 A
- B、 B
- C、 C
- D、 D
关于下列仪器使用的说法错误的是( )

- A、 ①、④不可加热
- B、 ②、④不可用作反应容器
- C、 ③、⑤可用于物质分离
- D、 ②、④、⑤使用前需检漏
下列由实验现象所得结论错误的是( )
- A、 向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO
具有氧化性
- B、 向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ)
- C、 向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2
- D、 向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应
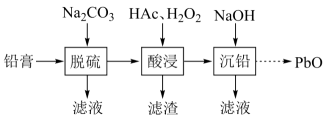
工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是( )

- A、 吸收过程中有气体生成
- B、 结晶后母液中含有NaHCO3
- C、 气流干燥湿料时温度不宜过高
- D、 中和后溶液中含Na2SO3和NaHCO3











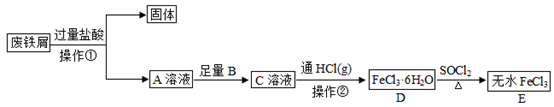
 ,其合成路线如下:
,其合成路线如下: 



 ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。