选择题
下列说法不正确的是( )
- A、 硅酸钠是一种难溶于水的硅酸盐
- B、 镁在空气中燃烧可生成氧化镁和氮化镁
- C、 钠与水反应生成氢氧化钠和氢气
- D、 常温下,铝遇浓硝酸或浓硫酸时会发生钝化
下列关于元素及其化合物的性质说法错误的是
- A、
和乙醇反应可生成
- B、 工业上煅烧黄铁矿
生产
- C、 工业上用氨的催化氧化制备
- D、 常温下铁与浓硝酸反应可制备
下列说法不正确的是( )
- A、 灼烧法做“海带中碘元素的分离及检验”实验时,须将海带进行灰化
- B、 用纸层析法分离铁离子和铜离子时,不能将滤纸条上的试样点浸入展开剂中
- C、 将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清
- D、 不能将实验室用剩的金属钠块放回原试剂瓶
下列方程式不能准确解释相应实验现象的是( )
- A、 酚酞滴入醋酸钠溶液中变为浅红色:CH3COO-+H2O⇌CH3COOH+OH-
- B、 金属钠在空气中加热生成淡黄色固体:4Na+O2=2Na2O
- C、 铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2
+3H2↑
- D、 将二氧化硫通入氢硫酸中产生黄色沉淀:SO2+2H2S=3S↓+2H2O
下列有关化学反应的叙述正确的是( )
- A、 室温下,Na在空气中反应生成Na2O2
- B、 室温下,Al与4.0 mol﹒L-1NaOH溶液反应生成NaAlO2
- C、 室温下,Cu与浓HNO3反应放出NO气体
- D、 室温下,Fe与浓H2SO4反应生成FeSO4
下列有关化学反应的叙述正确的是( )
- A、 Fe在稀硝酸中发生钝化
- B、 MnO2和稀盐酸反应制取Cl2
- C、 SO2与过量氨水反应生成(NH4)2SO3
- D、 室温下Na与空气中O2反应制取Na2O2
下列有关元素化合物的说法正确的是( )
- A、 元素的非金属性越强,简单氢化物的酸性越弱
- B、 由金属活动性顺序可知,钙比钠与水反应更剧烈
- C、 碳酸氢钠和碳酸钠均可用作食品膨松剂
- D、
与浓硫酸和稀硫酸反应时,硫酸同时体现酸性和氧化性
下列说法错误的是
- A、 硅酸钠是一种难溶于水的硅酸盐
- B、 镁在空气中燃烧可生成氧化镁和氮化镁
- C、 钠与水反应生成氢氧化钠和氢气
- D、 常温下,铝遇浓硝酸或浓硫酸时会发生钝化
下列说法正确的是( )
- A、 空气中久置的硫化钠会产生淡黄色浑浊
- B、 过量的铁在氯气中燃烧生成
- C、 硝酸工业中用浓硝酸吸收
制
- D、 实验室可以用铝和氢硫酸反应制硫化铝
化学与生活密切相关。下列说法错误的是( )
- A、 利用合适的催化剂可减少汽车尾气中有害气体的排放
- B、 钠着火可用泡沫灭火器灭火
- C、 高纯硅可用于制作光感电池
- D、 疫苗一般冷藏存放,以避免蛋白质变性
从古至今化学与生产、生活密切相关。下列说法错误的是( )
- A、 中华酒文化源远流长,酿酒过程中涉及水解反应、氧化反应等多种反应类型
- B、 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造机钛合金结构件;高温时可用金属钠还原相应的氯化物来制取金属钛
- C、 新冠疫情席卷全球,目前使用的一次性医用口罩(SMS),其原料是聚丙烯,能使溴水或酸性高锰酸钾溶液褪色
- D、 垃圾分类很重要,充电电池和硒鼓墨盒都属于有害垃圾
下列说法错误的是( )
- A、 钠着火不能用泡沫灭火器灭火
- B、
溶液中加少量铁屑防止
被氧化
- C、 苯酚和甲醛通过加聚反应制得酚醛树脂
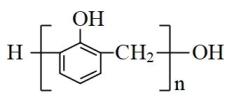
- D、 包装上有标记“OTC”的药物,消费者可以自行购买和使用
下列用于解释事实的方程式书写不正确的是( )
- A、 滴有酚酞的碳酸钠溶液呈红色:CO
+2H2O
H2CO3+2OH-
- B、 在空气中加热金属钠生成淡黄色固体:2Na+O2
Na2O2
- C、 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-=AlO
+2H2O
- D、 将氯气通入氢硫酸中产生黄色沉淀:H2S+Cl2=S↓+2HCl
下列说法错误的是
- A、 钠与CuO在高温下反应生成
- B、 可用Al与MgO发生反应制取Mg
- C、 Na、
等活泼的金属和非金属用电解法制得
- D、 FeO在空气里受热, 能迅速被氧化成
下列说法正确的是( )
- A、 纸层析法分离Fe3+和Cu2+ , 氨熏后纸条上端为棕红色,下端为深蓝色
- B、 从海带中提取碘的工业生产过程步骤:灼烧、浸泡、过滤、氧化、结晶、提纯
- C、 培养明矾晶体时,将小晶体悬挂在90℃热饱和溶液的烧杯中央,自然冷却至室温
- D、 金属钾、钠和白磷暴露空气中易燃烧,均应保存在煤油中
下列“类推”合理的是( )
- A、 Na与H2O反应生成NaOH和H2 , 则Fe与H2O反应生成Fe(OH)3和H2
- B、 CO2可与水反应生成H2CO3 , 则SiO2可与水反应生成H2SiO3
- C、 铁与硫加热反应生成FeS,则铜与硫加热反应生成Cu2S
- D、 Cl2与H2O反应生成HCl和HClO,则F2与H2O反应生成HF和HFO
下列有关钠及其化合物的性质与用途具有对应关系的是( )
- A、 钠单质熔点较低,可用于冶炼金属钛
- B、 次氯酸钠具有强氧化性,可用作环境消毒剂
- C、 氢氧化钠具有强碱性,可用作干燥剂
- D、 碳酸氢钠受热易分解,可用于泡沫灭火器
化学研究性学习小组设计了如下装置制备少量氯化钠。无法达到实验目的的是( )

- A、 用装置甲制取氯气
- B、 用装置乙净化、干燥氯气
- C、 用装置丙制备氯化钠
- D、 用装置丁吸收尾气
下列有关化学反应的叙述正确的是( )
- A、 Fe在稀硝酸中发生钝化
- B、 MnO2和稀盐酸反应制取Cl2
- C、 NO与空气混合溶于水能生成HNO3
- D、 室温下Na与空气中O2反应制取Na2O2
某小组同学探究金属钠与不同盐溶液的反应,进行了如下实验。下列说法错误的是( )
查阅资料:溶液中离子的浓度越大,离子所带的电荷数目越多,溶液的离子强度越大。
| 实验 | 序号 | 盐溶液 | 现象 |
| | ① | | 与钠与水的反应类似,钠熔化成一个闪亮的小球,四处游动,速度较快,没有火花出现 |
| ② | 2.0mol/LKCl溶液 | 反应比①剧烈,没有火花出现 | |
| ③ | | 反应比②剧烈,没有火花出现 | |
| ④ | | 反应瞬间即有黄色火花出现,并立即发生剧烈燃烧 |
- A、 由①②可知,随着KCl溶液浓度的增加,钠与KCl溶液的反应速率明显加快
- B、 实验③比②反应更加剧烈,一定是因为钠与碳酸根离子发生氧化还原反应
- C、 实验④中出现燃烧现象,是因为钠与水、与硝酸根离子发生了氧化还原反应,导致反应放出大量的热,达到了钠的着火点
- D、 推测若采用
溶液进行上述实验,也会出现钠的燃烧现象
下列有关化学反应的叙述正确的是( )
- A、 CuSO4稀溶液与Na反应析出Cu
- B、 Fe与水蒸气在高温下反应生成Fe2O3
- C、 SO2的水溶液与溴蒸气反应富集溴
- D、 饱和食盐水与通入的NH3、CO2反应析出Na2CO3固体
下列说法错误的是( )
- A、 工业上,在高温熔融、隔绝空气的条件下,利用钠单质和钛、钽等金属的氧化物发生置换反应,来制备钛、钽等稀有金属材料
- B、 铁的化合物应用十分广泛,氯化铁、硫酸亚铁是优良的净水剂
- C、 铜丝在氯气中燃烧,产生大量棕色的烟,实验结束后在集气瓶中加入少量水,盖上玻片后充分振荡,棕色消失,得到绿色溶液,再加水稀释,最终得到蓝色溶液
- D、 工业上锌可用湿法冶炼——电解 ZnSO4 溶液制备 Zn
下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入到FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④向饱和Na2CO3溶液中通入过量CO2 .
- A、 ①②③④
- B、 ①④
- C、 ③④
- D、 ②③
下列说法错误的是( )
- A、 铁、锰、铬以及它们的合金称为黑色金属材料
- B、 用铬酸作氧化剂可以使铝表面的氧化膜产生美丽的颜色
- C、 可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素
- D、 钠与水反应、镁与沸水反应、红热的铁与高温水蒸气反应均生成碱和氢气