选择题
元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,m是常见的金属单质,n通常为深红棕色液体;0.01mol/Lr溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法错误的是( )

- A、 q的溶液显酸性
- B、 W的氧化物常温常压下为液态
- C、 Z的氧化物的水化物一定为强酸
- D、 p不能使酸性高锰酸钾溶液褪色
短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是( )
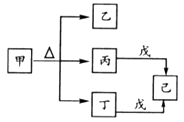
- A、 甲和戊加入水中都能破坏水的电离平衡
- B、 乙和戊都含有离子键
- C、 原子半径r(D)>r(B)>r(C)>r(A)
- D、 A,B,C形成的化合物一定显酸性
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是 ( )
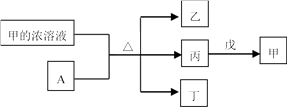
- A、 丁和戊中所含元素种类相同
- B、 简单离子半径大小:X<Y
- C、 气态氢化物的还原性:X>Z
- D、 Y的简单离子与Z的简单离子在水溶液中可大量共存
前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是( )

- A、 简单离子半径:Z>Y
- B、 反应①为吸热反应
- C、 反应②为工业上制备漂白粉的反应原理
- D、 X、Y分别与Z形成的化合物中,化学键类型一定相同
单质X有如右转化关系如下,单质X可能是( )
![]()
- A、 Fe
- B、 C
- C、 Si
- D、 Al
短周期元素W、X、Y、Z的原子序数依次增大,这些元素组成的单质和化合物转化关系如下图所示。其中C是淡黄色固体,B和E的水溶液均具有漂白性。下列说法错误的是( )
- A、 简单离子半径:Y>Z>X
- B、 沸点:D<A
- C、 气态氢化物稳定性:Z>Y
- D、 0.1mol·L-1A溶液中:c(H+)>c(HY-)>c(Y2-)
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是( )

- A、 简单离子的半径:Y>Z>X
- B、 简单氢化物的沸点:Y>X
- C、 最高价氧化物对应水化物的碱性:Z>Y
- D、 W、Y的氧化物所含化学键类型相同
同一短周期元素甲、乙、丙、丁原子序数依次增大。常温下,含甲的化合物r浓度为0.1mol·L-1时溶液pH=13。同周期元素简单离子中,乙离子的半径最小。p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如图所示(产物水已略去)。下列说法错误的是( )

- A、 原子半径的大小关系:甲>乙>丙>丁
- B、 反应②的离子方程式为:Cl2+H2O
H++Cl-+HClO
- C、 m、n的阴离子在酸性条件下不能大量共存
- D、 甲、乙、丁的最高价氧化物对应水化物两两之间均可以发生反应
a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法错误的是( )

- A、 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
- B、 若a为一种气态氢化物,X为O2 , 则a分子中可能含有10个或者18个电子
- C、 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
- D、 若a为固态非金属单质,X为O2 , 则O元素与a元素的原子序数之差可能为8
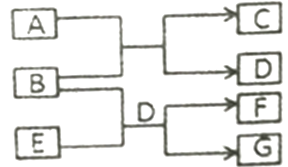
根据下列框图分析,下列说法正确的是( )

- A、 E2+的氧化性比M2+的氧化性强
- B、 在③反应中加稀硫酸可抑制Fe2+的水解
- C、 反应④的离子方程式可表示为:E3++3SCN﹣⇌E(SCN)3↓
- D、 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性
为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程,下列叙述中不正确的是( )

- A、n=0.02
- B、V=2240
- C、 m=3.2
- D、 元混合物中FeSO4的质量分数约为89%
某同学拟用含少量Fe2O3杂质的废铜粉制备无水硫酸铜,设计了如下流程:

下列有关说法不正确的是( )
- A、 “过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3
- B、 通入的气体A可以是O2或Cl2
- C、 通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+
- D、 将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜
三种不同物质有如图所示转化关系:甲  乙
乙  丙
丙  甲,则甲不可能是( )
甲,则甲不可能是( )
- A、 Al2O3
- B、 SiO2
- C、 CO2
- D、 NH4Cl
非选择题
短周期元素W,X,Y,Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) 
- A、 原子半径的大小W<X<Y
- B、 元素的非金属性Z>X>Y
- C、 Y的氢化物常温常压下为液态
- D、 X的最高价氧化物的水化物为强酸






















