选择题
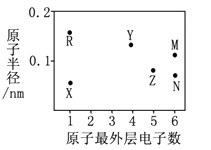
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )
- A、 常温常压下X的单质为气态
- B、 Z的氢化物为离子化合物
- C、 Y和Z形成的化合物的水溶液呈碱性
- D、 W与Y具有相同的最高化合价
根据元素周期表和元素周期律,判断下列叙述不正确的是( )
- A、 气态氢化物的稳定性:H2O>NH3>SiH4
- B、 氢元素与其他元素可形成共价化合物或离子化合物
- C、
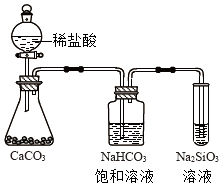 如图所示实验可证明元素的非金属性:Cl>C>Si
如图所示实验可证明元素的非金属性:Cl>C>Si - D、 用中文“
 ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的.由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生.下列说法不正确的是( )
- A、 X的简单氢化物的热稳定性比W强
- B、 Y的简单离子与X的具有相同的电子层结构
- C、 Y与Z形成的化合物的水溶液可使蓝色石蕊试纸变红
- D、 Z与X属于同一主族,与Y属于同一周期
短周期元素X、Y、Z、W、Q的原子序数依次增大,Q单质暗处遇 发生爆炸,由上述五种元素形成的化合物结构如图所示。下列说法错误的是
发生爆炸,由上述五种元素形成的化合物结构如图所示。下列说法错误的是
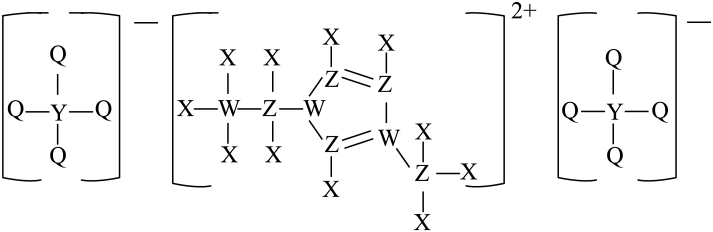
- A、 原子半径:Y>Z>W>Q
- B、 最高价氧化物对应水化物的酸性:W>Z>Y
- C、 氢化物的沸点:Q>Z>W
- D、 同周期中第一电离能小于W的元素有5种
X、Y、Z、W属于短周期主族元素,其中X、Y、Z在元素周期表中的相对位置关系如图,Y原子的最外层电子数是其次外层电子数的 , W的焰色反应呈现黄色火焰。下列说法错误的是( )
, W的焰色反应呈现黄色火焰。下列说法错误的是( )
X | |||
Y | Z |
- A、 原子半径:W>Y>Z>X
- B、 W和X形成的化合物可能含共价键
- C、 气态氢化物的稳定性X>Z>Y
- D、 Z2X5可以用作食品干燥剂
短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,W与Y同族且W原子的质子数是Y原子的一半。下列说法正确的是( )
- A、 原子半径:r(X)>r(Y)>r(W)
- B、 Y的最高价氧化物对应水化物的酸性比Z的强
- C、 由W、Y形成的化合物是离子化合物
- D、 由X、Y形成的化合物的水溶液呈中性
M、X、Y、Z、W为五种短周期元素,且原子序数依次增大,X、Y、Z最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L−1;W的质子数是X、Y、Z、M四种元素质子数之和的 。下列说法正确的是( )
。下列说法正确的是( )
- A、 原子半径:W>Z>Y>X>M
- B、 常见气态氢化物的稳定性:X<Y<Z
- C、 1molWM溶于足量水中完全反应,共转移2mol电子
- D、 由M、X、Y、Z四种元素形成的化合物一定既有离子键,又有共价键
某多孔储氢材料前驱体结构如图,M、 W、X、Y、Z五种元素原子序数依次增大,Z原子最外层电子数是其电子层数的3倍。下列说法一定正确的是( )

- A、 Z的氢化物只含极性键
- B、 该化合物的阴离子中除M原子外的其他原子均满足最外层8电子稳定结构
- C、 Y的氢化物沸点比X的氢化物的沸点高
- D、 已知H3WO3的解离反应:H3WO3 +H2O
H+ +
;Ka=5.81×10-10 , 可判断1 mol H3WO3最多可消耗3molNaOH
我国科学家发现某化合物(如图所示)可用于制造大功率固体激光器,填补国家空白。已知X、Y、Z、W为前20号元素且位于不同周期,原子序数依次递增,Y为地壳中含量最多的元素。下列有关说法正确的是( )

- A、 原子半径:
- B、 该化合物易溶于水且水溶液显碱性
- C、 Z的最高价氧化物对应的水化物为强酸
- D、 单质的氧化性:
, 单质的还原性:
X、Y 、Z、W为前四周期原子序数依次增大的四种元素,X、Y为同周期且相邻元素,X原子的核外电子数等于Z的最外层电子数,X、Z原子核外电子数之和为Y原子核外电子数的3倍。W是人类最早掌握其冶炼技术的金属。下列说法错误的是( )
- A、 X、Y形成的某些化合物可形成光化学烟雾
- B、 简单离子半径:X> Y> Z
- C、 加热蒸干WZ2溶液不能得到纯净的WZ2固体
- D、 Y、Z形成的一种化合物是一种常用的消毒剂
Z、Y、X、W、Q为五种原子序数依次增大的短周期主族元素。其中Z、Y、W分别位于三个不同周期,Y、Q位于同一主族,Y原子的最外层电子数是W原子的最外层电子数的2倍,Y、X、W三种简单离子的核外电子排布相同。由Z、Y、X、W形成的某种化合物的结构如图所示。下列说法错误的是( )

- A、 简单氢化物的稳定性:
- B、 该物质中所有原子均满足最外层
的稳定结构
- C、 X与Y、Y与Z均可形成含非极性共价键的化合物
- D、 W与X两者的最高价氧化物对应的水化物之间可发生反应
一种外用消炎药主要成分的结构如图所示。分子结构中的苯环和甲基部分已给出,X、Y、Z、W、M为原子序数依次增大的短周期主族元素,其中X的原子序数大于碳,W与Y同主族。下列说法正确的是( )

- A、 原子半径:Z>Y>X
- B、 简单氢化物的沸点:Y>M>X
- C、 WY2能够使紫色石蕊试液褪色
- D、 最高价氧化物对应水化物的酸性:M>W
中国画传统黄色颜料雄黄和雌黄均为As的硫化物,二者的球棍模型如图所示,已知As位于元素周期表中第四周期ⅤA族,下列说法错误的是( )

- A、 模型中白球代表硫原子
- B、 非金属性:
- C、 雄黄和雌黄中As元素均为+3价
- D、 雄黄的化学式为
短周期主族元素X、Y、Z、W的原子序数依次增大。元素X在常见化合物中均显负价,X、Y的最外层电子数之和与W的最外层电子数相等,Z的单质能与Y的最高价氧化物对应的水化物反应且有氢气生成。下列说法一定正确的是( )
- A、 简单离子半径的大小顺序:W>Y>X
- B、 Z的最高价氧化物对应的水化物是两性氢氧化物
- C、 X的最简单氢化物沸点高于W的最简单氢化物沸点
- D、
和
均具有漂白性,但漂白原理不同
某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,Z原子最外层电子数是电子层数的3倍。下列说法正确的是( )
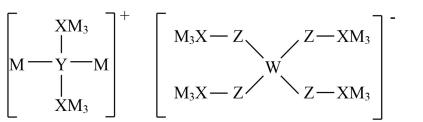
- A、 Z的氢化物只含极性键
- B、 原子半径:M>W>X>Y>Z
- C、 Y的氢化物沸点一定比X的氢化物的沸点高
- D、 已知H3WO3的解离反应:H3WO3+H2O⇌H++W(OH)
, Ka=5.81×10-10 , 可判断H3WO3是一元弱酸
我国“祝融号”火星车首次在火星上探测到含水矿物,通过分析发现矿物含有a、b、c、d四种原子序数依次增大的短周期主族元素,岩石中含有cdb3 , 其中b也是地球地壳中含量最高的元素,c为金属元素,其单质与热水反应后的溶液能使酚酞试液变为浅红色,a、d为同一主族元素。下列判断错误的是( )
- A、 原子半径:c>d>a>b
- B、 b分别和a、c、d形成的化合物化学键类型相同
- C、 a的氢化物的沸点可能高于b的氢化物的沸点
- D、 从海水中提取c的过程中,工业生产常选用Ca(OH)2作为沉淀剂
已知金属性:铁<铬(Cr)<锌。下列说法错误的是( )
- A、 铬能与冷水发生剧烈反应
- B、 Cr(OH)3的碱性比NaOH弱
- C、 铬能与稀盐酸发生反应
- D、 Al能与Cr2O3反应置换出Cr
W、X、Y、Z为原子序数依次增大的短周期主族元素,W和Z同主族,Y、Z的原子序数分别是W、X的2倍,X的单质在空气中含量最多,下列说法一定错误的是( )
- A、 简单离子半径大小:X>Y
- B、 X的简单氢化物的沸点比相邻同族元素的高
- C、 一定条件下,Y单质在空气中点燃可生成两种离子化合物
- D、 高温下W单质与Z的氧化物发生置换反应,则非金属性:W>Z
X、Y、Z、W、R是周期表中的短周期主族元素,原子半径依次增大。X和Z的基态原子的2p能级上各有两个未成对电子,W在周期表中位于ⅡA族。下列说法正确的是( )
- A、 简单离子半径:
- B、 Y的第一电离能在五种元素中最大
- C、 R的最高价氧化物对应水化物的可能具有酸性
- D、 元素电负性
a、b、c、d、e为原子序数依次增大的五种短周期元素。a、c同主族,离子化合物ca与水反应生成强碱X和a的单质。b、e同主族,化合物eb2是常见大气污染物。d的核电荷数比e少3。下列说法错误的是( )
- A、 化合物a2e沸点比a2b的低
- B、 化合物c2b2中既含有离子键又有共价键
- C、 d单质可溶于X溶液
- D、 离子半径:c>d>e>b
某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,Z比Y的原子序数大9。下列说法正确的是( )

- A、 最高价氧化物的水化物酸性 Y>X
- B、 原子半径:
- C、 简单氢化物的沸点:
- D、 M、Y、Z不能形成离子化合物
某化合物可用作发酵助剂,结构如图所示。图中X、Y、Z、W为元素周期表中前20号元素,且位于不同周期,它们的原子序数依次增大,其中Y为地壳中含量最高的元素。下列有关说法正确的是( )

- A、 该化合物中除X外,其他原子最外层不一定均为8
- B、 Z元素形成的单质均为白色固体
- C、 X分别与Y、Z、W形成的简单化合物中均含有共价键
- D、 Z的最高价氧化物的水化物的酸性强于硫酸
短周期元素X、Y、Z、Q、R的原子序数依次增大,且X、Y、Q、R的原子的最外层电子数之和为12,X与R同主族,Q是地壳中含量最高的元素。下列说法错误的是( )
- A、 简单离子半径大小顺序为: Z>Q>R
- B、 最简单氢化物的沸点高低顺序为: Q>Z> Y
- C、 X与Q形成的化合物仅含共价键
- D、 Q与R形成的常见化合物中,阴、阳离子数目之比为1∶2