选择题
下列实验中的颜色变化,与氧化还原反应无关的是( )
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
- A、 A
- B、 B
- C、 C
- D、 D
下列变化中,气体被还原的是( )
- A、 二氧化碳使Na2O2固体变白
- B、 氯气使KBr溶液变黄
- C、 乙烯使Br2的四氯化碳溶液褪色
- D、 氨气使AlCl3溶液产生白色沉淀
下列能量转化过程与氧化还原反应无关的是( )
- A、 硅太阳能电池工作时,光能转化成电能
- B、 锂离子电池放电时,化学能转化成电能
- C、 电解质溶液导电时,电能转化成化学能
- D、 葡萄糖为人类生命活动提供能量时,化学能转化成热能
光催化 还原是一种有望在固碳和绿色能源领域应用的技术。水溶液中复合材料
还原是一种有望在固碳和绿色能源领域应用的技术。水溶液中复合材料 光催化
光催化 还原为醇类的机理图如图,
还原为醇类的机理图如图, 是电子跃迁后留下的空穴,具有强氧化性。下列说法错误的是
是电子跃迁后留下的空穴,具有强氧化性。下列说法错误的是

- A、
在富集空穴的
材料上发生氧化反应
- B、 光催化
还原在一定条件下也可以生成甲烷等有机物
- C、 光催化过程的总反应是
和
- D、
材料上富集还原性强的光生电子将
还原,当消耗标准状况下
时,转移
电子
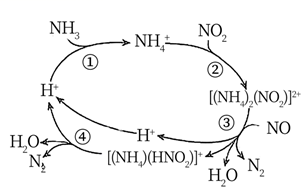
碘在地壳中主要以 形式存在,在海水中主要以
形式存在,在海水中主要以 形式存在,几种粒子之间的转化关系如图所示。下列说法正确的是
形式存在,几种粒子之间的转化关系如图所示。下列说法正确的是

- A、 由题图可知氧化性的强弱顺序:
- B、 可利用
与
在一定条件下反应制备
- C、 途径III中若反应
, 则反应中转移
电子
- D、 在淀粉碘化钾溶液中逐滴滴加氯水,不能观察到溶液变蓝现象
关于反应 , 下列说法正确的是
, 下列说法正确的是
- A、
可以和
反应,生成
- B、
是氧化产物
- C、
既是氧化剂又是还原剂
- D、 生成
, 转移
个电子
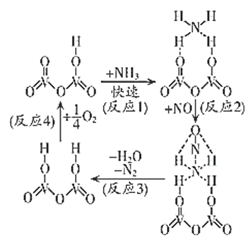
我国建成全球首套千吨级液态太阳燃料合成示范装置,其原理如图所示。下列说法错误的是

- A、 太阳能在此过程中主要转化为电能和化学能
- B、 反应Ⅰ和反应Ⅱ都属于氧化还原反应
- C、
中存在的化学键有:离子键、共价键、氢键
- D、 该过程产生的氢气和甲醇都可作为燃料电池燃料
下列变化过程中,存在氮元素被氧化过程的是
- A、 工业合成氨
- B、 NO2溶于水
- C、 NH4Cl热分解
- D、 KNO3熔化
下列过程不涉及氧化还原反应的是
- A、 自然固氮
- B、 纯碱除油污
- C、 海水提溴
- D、 电解精炼铜
利用V2O3制备氧钒碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9]·10H2O}的工艺流程如下:

已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
- A、 V2O3制备NaVO3过程中,氧化剂与还原剂物质的量之比为1:2
- B、 生成V2O5的反应为2NaVO3+2NH4Cl
2NaCl+V2O5+2NH3↑
- C、 由V2O5制备VOCl2的两种路径,路径I更符合绿色化学思想
- D、 路径II中若盐酸浓度过低,可能生成副产物VO2Cl
废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb及少量BaSO4 , 从中回收PbO的工业流程及一些难溶电解质的溶度积常数如下:

难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
下列说法错误的是
- A、 “脱硫”的目的是将PbSO4转化为PbCO3
- B、 滤渣的主要成分为BaSO4
- C、 “酸浸”时加入的H2O2既可做氧化剂又可做还原剂
- D、 “沉铅”后的滤液中存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
在Fe2+催化作用下,C2H6与N2O制备乙醛的反应机理如图所示。下列说法正确的是

- A、 X为C2H5OH,是中间产物之一
- B、 过程①~⑥,Fe元素的化合价均发生了变化
- C、 增加Fe+的量,C2H6平衡转化率不变
- D、 每消耗1molN2O,可制备0.5molCH3CHO
工业上可利用反应Na2SO4 + 2C Na2S + 2CO2↑来制备硫化钠,下列说法错误的是
Na2S + 2CO2↑来制备硫化钠,下列说法错误的是
- A、 Na2S溶液显碱性是由于S2-+ 2H2O
H2S + 2OH-
- B、 反应中,消耗1 mol碳时,可生成22.4 L 标准状况下的CO2
- C、 反应中,生成1 mol Na2S时,转移8 mol电子
- D、 该反应中氧化剂和还原剂的物质的量比为1∶2
海水是一个巨大的资源宝库,下图是从海水中提取镁的流程图。

以下说法错误的是( )
- A、 反应
中,氧化还原反应有
个
- B、 电解槽中的反应在常温下即可发生,节约能源
- C、 使用贝壳为原料制备
, 可降低生产成本
- D、 实验室模拟浓缩池中的过程,需要在
气氛中蒸发浓缩
2020年11 月7日是被誉为“中国稀土之父”的徐光宪先生诞辰一百周年纪念日。铈(Ce)是地壳中含量最高的稀土元素。金属铈在空气中易被氧化变暗,能与水反应,常见的化合价为+3和+4,氧化性: Ce4+ >Fe3+。下列说法正确的是
- A、 铈元素在自然界中主要以化合态形式存在
- B、 可通过电解Ce(SO4)2溶液制得金属铈
- C、 铈能从硫酸铜溶液中置换出铜:Ce+2Cu2+=2Cu+Ce4+
- D、 CeO2溶于氢碘酸的化学方程式可表示为CeO2+4HI=CeI4+2H2O
胍盐是病毒核酸保存液的重要成分之一。胍在碱性条件下不稳定,易水解,反应方程式如下:下列有关说法正确的是
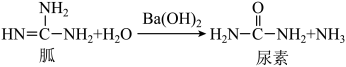
- A、 核酸可以发生水解反应,属于高分子化合物
- B、 胍的水解反应为氧化还原反应
- C、 胍分子中氮原子只有一种杂化方式
- D、 胍可看作强碱,胍分子中所有原子可以共平面