多选题
选择题
五种主族元素在周期表中的位置如图所示。L的单质在常温常压下呈液态,且保存时需要用水液封。下列推断正确的是( )
| X | Y | Z | T | |
| L |
- A、 原子半径:X<Y<Z<T<L
- B、 气态氢化物的还原性:L>Z>T
- C、 X的电负性是五种元素中最小的
- D、 Y和T组成的化合物是离子化合物
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、CuCl2的混合溶液中反应回收S,其物质转化过程如下图所示。下列叙述错误的是( )
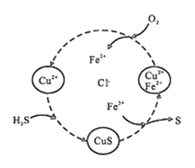
- A、 反应过程中,CuCl2、FeCl3可以循环利用
- B、 反应的总方程式为:2H2S+O2
2S↓+2H2O
- C、 由图示的转化可得出:氧化性的强弱顺序为O2>Cu2+>S
- D、 保持溶液中Fe3+的量不变,反应中消耗标况下22.4L的O2 , 可以生成64g硫
反应2Na2S2O3+I2→ 2NaI+ Na2S4O6常用于定量分析。下列相关说法错误的是( )
- A、 反应中,每生成1 mol Na2S4O6 , 就有4 mol 电子发生转移
- B、 反应中,I2表现了氧化性
- C、 I2被还原,Na2S4O6是氧化产物
- D、 Na2S2O3溶液最好即配即用,久置空气易被氧化,可能生成Na2SO4
次磷酸(H3PO2)与磷酸(H3PO4)的正盐性质如下表。正盐NaH2PO2有较强的还原性,可将硝酸银溶液中的Ag+转化为银,此时氧化剂与还原剂物质的量之比为4:1。
| 化学式 | Na3PO4 | NaH2PO2 |
| 物质类别 | 正盐 | 正盐 |
| 溶液酸碱性 | 碱性 | 中性 |
关于该氧化还原反应的判断正确的是( )
- A、 H3PO2是三元酸
- B、 反应前后溶液的pH无变化
- C、 反应的离子方程式为:H2PO
+4Ag++2H2O
4Ag↓+PO
+6H+
- D、 硝酸银发生还原反应
为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成SeO2 , 再用KI溶液处理后回收Se。发生反应:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②SeO2+4KI+4HNO3=4KNO3+Se+2I2+2H2O,下列说法正确的是( )
- A、 ①中SO2是氧化产物,SeO2是还原产物
- B、 ②中HNO3是氧化剂,KI是还原剂
- C、 由①②可知浓硫酸能将KI氧化生成I2
- D、 由①②可知还原性由强到弱的顺序:Se>KI>SO2
I-具有还原性,含碘食盐中的碘元素以KIO3的形式存在,I-、I2、IO  在一定条件下可以发生如图转化关系,下列说法错误的是( )
在一定条件下可以发生如图转化关系,下列说法错误的是( )

- A、 由图可知氧化性的强弱顺序为Cl2 > IO
> I2
- B、 用淀粉碘化钾试纸和白醋可检验食盐是否加碘
- C、 生产等量的碘,反应①和反应②转移电子数目之比为2∶5
- D、 反应③的离子方程式:3Cl2+ I-+3H2O →6Cl- + IO
+6H+
对于铝和烧碱溶液的反应,下列说法错误的是( )
- A、 铝是还原剂
- B、
是氧化剂
- C、
与
是氧化剂
- D、 氢气是还原产物
硝酸厂的尾气中含有大量的氮氧化物(NOx),将尾气与H2混合,通入Ce(SO4)2与Ce2(SO4)3的混合溶液中实现无害化处理,其转化过程如图所示。下列说法正确的是( )

- A、 该转化过程的实质为NOx被H2还原
- B、 过程I发生反应的离子方程式:H2+Ce4+=2H++Ce3+
- C、 处理过程中,混合溶液中Ce3+和Ce4+总数减少
- D、 x=1时,过程II中氧化剂与还原剂的物质的量之比为2:1
硝酸厂的烟气中含有大量的氮氧化物(NOx),为保护环境,将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3[Ce中文名“铈”]的混合溶液中实现无害化处理,其转化过程如图。下列说法正确的是( )

- A、 过程Ⅰ发生反应的离子方程式:H2+Ce4+=2H++Ce3+
- B、 处理一段时间后,混合溶液中Ce3+和Ce4+浓度不变
- C、 该转化过程的实质为NOx被H2还原
- D、 x=1时,过程中氧化剂与还原剂的物质的量之比为2:1
下列反应中,酸体现还原性的是( )
- A、
与浓盐酸共热制
- B、
与浓硫酸共热制
- C、
与稀硫酸反应制
- D、
与稀硝酸反应制备
工业上利用反应  检查氯气管道是否漏气。下列说法错误的是( )
检查氯气管道是否漏气。下列说法错误的是( )
- A、 将浓氨水接近管道,若产生白烟说明管道漏气
- B、
的电子式为:

- C、
中只含有离子键
- D、 该反应中氧化剂和还原剂的物质的量之比为
实验室可用KMnO4代替MnO2与浓盐酸反应,在常温下快速制备Cl2 , 反应原理为:2KMnO4+16HCl(浓)=5Cl2↑+2KCl+2MnCl2+8H2O。下列说法错误的是( )
- A、 Cl2是氧化产物
- B、 浓盐酸在反应中只体现还原性
- C、 每生成标准状况下2.24LCl2 , 转移0.2mol电子
- D、 反应中KMnO4的氧化性强于Cl2
氢化亚铜(CuH)是一种红棕色的难溶物,可在40℃~50℃时用CuSO4溶液和“另一种反应物”制取。CuH在Cl2中能燃烧生成CuCl2和HCl;CuH跟盐酸反应生成CuCl难溶物和H2。下列推断错误的是( )
- A、 “另一种反应物”在反应中表现还原性
- B、 CuH与Cl2反应的化学方程式为:2CuH + 3Cl2
2CuCl2 + 2HCl
- C、 CuH与Cl2反应时,CuH做还原剂
- D、 CuH与盐酸反应的离子方程式为:CuH + H+ = Cu+ + H2↑
下列氧化还原反应中,水作氧化剂的是( )
- A、 C+H2O
CO+H2
- B、 2Na2O2+2H2O=4NaOH+O2↑
- C、 2F2+2H2O=4HF+O2
- D、 3NO2+H2O=2HNO3+NO
下列反应中,水只作氧化剂的是( )
- A、
与水反应
- B、
与水反应
- C、
与水反应
- D、
与水蒸气反应
下列变化中,气体被还原的是( )
- A、 将SO2气体通入品红溶液,溶液红色褪去
- B、 将氯气通入KBr溶液,溶液变黄
- C、 氢气通入氧化铜中加热,黑色固体变为红色
- D、 氨气通入AlCl3溶液产生白色沉淀
将浓盐酸滴入  溶液中,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入
溶液中,产生黄绿色气体,溶液的紫红色褪去,向反应后的溶液中加入  ,溶液又变为紫红色,
,溶液又变为紫红色,  反应后变为无色的
反应后变为无色的  。下列说法错误的是( )
。下列说法错误的是( )
- A、 滴加盐酸时,
是氧化剂,
是氧化产物
- B、 此实验条件下,还原性:
- C、 若有
参加了反应,则整个过程转移电子为
- D、 已知
为第
族元素,上述实验说明
具有较强的非金属性
双碱法脱硫过程如图所示。下列说法错误的是( )

- A、 过程Ⅰ中,SO2表现还原性
- B、 过程Ⅱ中,1 mol O2可氧化2 mol Na2SO3
- C、 双碱法脱硫过程中,NaOH可以循环利用
- D、 总反应为
向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法错误的是( )
- A、 Cu2+将H2O2还原为O2
- B、 H2O2既表现氧化性又表现还原性
- C、 Cu2+是H2O2分解反应的催化剂
- D、 发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O




