选择题
标准状态下,气态分子断开1mol化学键的焓变为键焓.已知H﹣H,H﹣O和O=O键的键焓△H分别为436kJ•mol﹣1、463kJ•mol﹣1和495kJ•mol﹣1 . 下列热化学方程式正确的是( )
- A、 H2O(g)═H2(g)+
O2(g)△H=﹣485kJ•mol﹣1
- B、 H2O(g)═H2(g)+
O2(g)△H=+485kJ•mol﹣1
- C、 2H2(g)+O2(g)═2H2O(g)△H=+485kJ•mol﹣1
- D、 2H2(g)+O2(g)═2H2O(g)△H=﹣485kJ•mol﹣1
二氧化碳捕获技术可用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中  催化合成甲酸是一种很有前景的方法,且生成的甲酸是重要化工原料,该反应在无催化剂和有催化剂时的能量变化如图所示:
催化合成甲酸是一种很有前景的方法,且生成的甲酸是重要化工原料,该反应在无催化剂和有催化剂时的能量变化如图所示:

下列说法正确的是( )
- A、 由图可知,过程I是有催化剂的能量变化曲线
- B、
催化合成甲酸的热化学方程式为
- C、 该反应的原子利用率为100%,符合绿色化学的理念
- D、 该反应可用于
的吸收和转化,有助于缓解酸雨的形成
“氯化反应”通常指将氯元素引入化合物中的反应。计算机模拟单个乙炔分子和氯化氢分子在催化剂表面的反应历程如图所示。下列说法正确的是( )

- A、 该反应的热化学方程式为HC≡CH(g)+HCl(g)=H2C=CHCl(g) △H=-2.24×10-24 eV·mol-1
- B、 反应物或产物在催化剂表面进行物理吸附和解吸附
- C、 该历程中活化能为1.68×10-24 eV
- D、 碳碳三键键能:CH≡CH>M1
以  为催化剂的光热化学循环分解
为催化剂的光热化学循环分解  反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。

下列说法正确的是( )
- A、 过程①中钛氧键断裂会释放能量
- B、 该反应中,光能和热能转化为电能
- C、 使用
作催化剂可以降低反应的活化能,从而提高化学反应速率
- D、
分解反应的热化学方程式为
多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜催化剂上的反应机理和能量变化如图。


下列说法正确的是( )
- A、 反应过程只有C-H键断开
- B、 反应I的活化能为
- C、 总反应的热化学方程式为:
- D、 反应历程中,反应Ⅱ决定整个反应进程的快慢
已知:① 2C(s)+O2(g)=2CO(g);ΔH= -220kJ·mol-1
② 氢气燃烧的能量变化示意图:

下列说法正确的是( )
- A、 1mol C(s)完全燃烧放出110 kJ的热量
- B、 H2(g)+1/2O2(g)=H2O(g);ΔH= -480kJ·mol-1
- C、 C(s)+H2O(g)=CO(g)+H2(g);ΔH= +130kJ·mol-1
- D、 欲分解2mol H2O(l),至少需要提供4×462kJ的热量
CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。

下列说法错误的是( )
- A、 步骤①只有非极性键断裂
- B、 步骤②速率最慢的原因可能是其活化能最高
- C、 步骤③需要吸收热量
- D、 使用该催化剂不能有效提高CO的平衡转化率
用 NA 表示阿伏加德罗常数的值,下列说法正确的是( )
- A、 标准状况下,22.4 L NO 和 22.4 L O2 混合后的分子总数为 2 NA
- B、 0.1mol•L-1 的氨水中,溶液中各微粒的物质的量存在以下关系:n(NH 4+)+n(NH3)+n(NH •H2O)=0.1 mol
- C、 已知氢气的热值为 143kJ•g-1 , 则氢气充分燃烧的热化学方程式可表示为: H2(g)+
O2(g)= H2O(l) ΔH=-286 kJ•mol −1
- D、 用酸性高锰酸钾溶液检验火柴头燃烧产生的 SO2 气体,当 10mL0.1mol•L-1 的酸性高锰酸钾溶液刚好褪色时,转移的电子总数为 0.0025NA
已知N≡N、N—H、H—H的键能分别为946 kJ·mol-1、391 kJ·mol-1、436 kJ·mol-1。下列说法正确的是( )
- A、 N2与H2在一定条件下化合生成2 mol NH3时放出的热量为92 kJ
- B、 一定条件下合成氨反应N2+3H2
2NH3达平衡时,3v(H2)正=2v(NH3)逆
- C、 用液氨和液氧制成的燃料电池放电时可实现将化学能全部转化为电能
- D、 反应NH3(g)+HCl(g)=NH4Cl(s)常温下能自发进行,该反应的ΔH>0
已知常温下氨气能与 CaCl2 固体结合生成 CaCl2·8NH3。下列说法错误的是( )
- A、 CaCl2·6NH3(s)+ 2NH3(g)
CaCl2·8NH3(s) ΔH < 0
- B、 实验室可用氯化铵固体和熟石灰共热来制备氨气,说明相对高温不利于 CaCl2 与氨气的化合
- C、 常温下,在密闭容器中缩体加压能增加体系中活化分子百分数,有利于氨气的吸收
- D、 CaCl2·6NH3(s) CaCl2·c4NH3(s)+ 2NH3(g),He 气流可促进反应进行
偏二甲肼[(CH3)2N-NH2](N为-2价)与N2O4是常用的火箭推进剂,发生的化学反应如下:(CH3)2N-NH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g)△H<0,下列说法错误的是( )
- A、 该反应在任何情况下都能自发进行
- B、 1mol(CH3)2N-NH2含有11mol共价键
- C、 反应中,氧化产物为CO2 , 还原产物为N2
- D、 反应中,生成1molCO2时,转移8mole-
乙烯与水加成制备乙醇的能量变化过程如下图所示。下列说法不正确的是( )
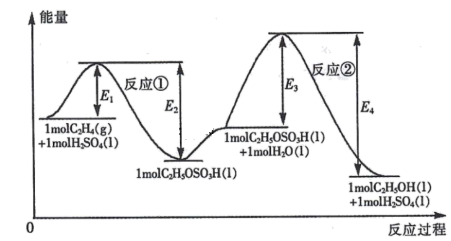
- A、 H2SO4是该合成过程的催化剂
- B、 合成过程的速率由反应②决定
- C、 反应①和反应②均为放热反应
- D、 C2H4 (g) +H2O(1) =C2H5OH(l )△H =(E1- E4)kJ• mol-1
根据下图所得判断正确的是( )

已知:H2O(g) = H2O(l) △H=﹣44 kJ/mol
- A、 图 1 反应为吸热反应
- B、 图 1 反应使用催化剂时,会改变其△H
- C、 图 2 中若 H2O 的状态为液态,则能量变化曲线可能为①
- D、 图 2 中反应为 CO2(g) + H2(g) = CO(g) + H2O(g) △H= + 41 kJ/mol
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中  假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计  ,使其达到分解平衡:
,使其达到分解平衡:  。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度 | | | | | |
| 平衡气体总浓度 | | | | | |
下列有关叙述正确的是( )
- A、 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
- B、 因该反应
、
,所以在低温下自发进行
- C、 达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
- D、 根据表中数据,计算
时的分解平衡常数约为
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g) =CO(g)+H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
- A、 反应①中电能转化为化学能
- B、 反应②为放热反应
- C、 反应③使用催化剂,ΔH3减小
- D、 反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:

相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l) = 2HI(aq) + H2SO4(aq) ΔH1=﹣213 kJ·mol-1
反应II:H2SO4(aq) = SO2(g) + H2O(l) + O2(g) ΔH2= +327 kJ·mol-1
反应III:2HI(aq) = H2(g) + I2(g) ΔH3= +172 kJ·mol-1
下列说法错误的是:( )
- A、 该过程实现了太阳能到化学能的转化
- B、 SO2和I2对总反应起到了催化剂的作用
- C、 总反应的热化学方程式为:2H2O(l) = 2H2 (g)+O2(g) ΔH = +286 kJ·mol-1
- D、 该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
已知在25 ℃、1.01×105 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如下图所示,下列有关说法正确的是( )

- A、 H2O分解为H2与O2时放出热量
- B、 热化学方程式为:2H2(g) + O2(g) = 2H2O(g) ΔH = -490 kJ·mol-1
- C、 甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
- D、 乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1反应Ⅱ:N2H4(g)+H2(g)2NH3(g)ΔH2=-41.8 kJ·mol-1

下列说法错误的是( )
- A、 图所示过程①是放热反应
- B、 反应Ⅱ的能量过程示意图如图所示
- C、 断开3 mol N2H4(g)的化学键吸收的能量大于形成1 molN2(g)和4 mol NH3(g)的化学键释放的能量
- D、 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g)ΔH=+50.7 kJ·mol-1
图分别表示红磷、白磷燃烧时的能量变化,下列说法中正确的是( )

- A、 白磷比红磷稳定
- B、 白磷燃烧产物比红磷燃烧产物稳定
- C、 1mol白磷转变为红磷放出2244.7kJ的热量
- D、 红磷燃烧的热化学方程式:4P(s)+5O2(g)=P4O10(s)△H=-2954kJ⋅mol−1
1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是( )
- A、 C(s)+O2(g)→CO2(g)+393kJ
- B、 C + O2→ CO2+393kJ
- C、 C (s) + O2 (g)→CO2 (g)-393kJ
- D、 C (s) +1/2O2 (g) → CO(g) +393kJ




