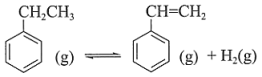
选择题
某小组进行实验,向 蒸馏水中加入
蒸馏水中加入 , 充分振荡,溶液呈浅棕色,再加入
, 充分振荡,溶液呈浅棕色,再加入 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |
|
| B | 溶液颜色加深 | 发生了反应: |
| C | 紫黑色晶体消失 |
|
| D | 溶液褪色 |
|
- A、 A
- B、 B
- C、 C
- D、 D
标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知 和
和 的相对能量为0],下列说法错误的是
的相对能量为0],下列说法错误的是

- A、
- B、 可计算
键能为
- C、 相同条件下,
的平衡转化率:历程Ⅱ>历程Ⅰ
- D、 历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:
乙醇-水催化重整可获得 。其主要反应为
。其主要反应为 ,
,  , 在
, 在 、
、 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和CO的选择性及
和CO的选择性及 的产率随温度的变化如图所示。
的产率随温度的变化如图所示。

CO的选择性 , 下列说法正确的是( )
- A、 图中曲线①表示平衡时
产率随温度的变化
- B、 升高温度,平衡时CO的选择性增大
- C、 一定温度下,增大
可提高乙醇平衡转化率
- D、 一定温度下,加入
或选用高效催化剂,均能提高平衡时
产率
恒容密闭容器中,以硫( )与
)与 为原料制备
为原料制备 ,
,  受热分解成气态
受热分解成气态 , 发生反应
, 发生反应
 。
。 的平衡转化率、
的平衡转化率、 的体积分数随温度的变化曲线如图所示。下列说法正确的是
的体积分数随温度的变化曲线如图所示。下列说法正确的是

- A、
- B、 温度升高,
分解率增大,
体积分数增大
- C、 向平衡体系中充入惰性气体,平衡向右移动
- D、 其他条件相同,
体积分数越大,
平衡转化率越小
在一定条件下探究二甲醚的制备反应: ,
,  , 测定结果如图所示。下列判断错误的是
, 测定结果如图所示。下列判断错误的是

- A、 该反应的
- B、 加入催化剂可以提高CO的平衡转化率
- C、 工业选择的较适宜温度范围为280~290℃
- D、 该反应伴随有副反应的发生
已知反应:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W=
CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按W= 向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度T、W的关系,图乙表示正、逆反应的平衡常数与温度的关系。则下列说法中错误的是

- A、 图甲中W2>1
- B、 图乙中,A线表示逆反应的平衡常数
- C、 温度为T1 , W=2时,Cl2的转化率为50%
- D、 若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强增大
向一个 的绝热刚性容器中通入
的绝热刚性容器中通入 和
和 , 在一定条件下发生反应
, 在一定条件下发生反应 , 正反应速率随时间变化的示意图如下,下列结论正确的是
, 正反应速率随时间变化的示意图如下,下列结论正确的是

- A、 升高温度,该反应的平衡常数将增大
- B、 从反应开始到达到平衡,逆反应速率先增大后减小
- C、 体系压强不再变化,说明反应达到平衡
- D、 从容器中分离出少量
后,
增加,
减小,平衡正向移动
用 和
和 可以合成甲醇。其主要反应为
可以合成甲醇。其主要反应为
反应I
反应Ⅱ
在恒容密闭容器内,充入1mol 和3mol
, 测得平衡时
转化率,CO和
选择性随温度变化如图所示[选择性
]。

下列说法正确的是
- A、 270℃时主要发生反应Ⅱ
- B、 230℃下缩小容器的体积,n(CO)不变
- C、 250℃下达平衡时,
- D、 其他条件不变,210℃比230℃平衡时生成的
多
CO2-H2催化重整可获得CH3OH。其主要反应为
反应I: CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H1=-53.7kJ·mol-1
反应II:CO2(g) + H2(g)= CO(g) + H2O(g) △H2=+41kJ·mol-1
若仅考虑上述反应,在5.0 MPa、n始(CO2): n始(H2)=1:3时,原料按一定流速通过反应器,CO2的转化率和CH3OH的选择性随温度变化如图所示。CH3OH的选择性=

下列说法正确的是
- A、 其他条件不变,升高温度,CO2的平衡转化率增大
- B、 其他条件不变,T>236℃时,曲线下降的可能原因是反应1正反应程度减弱
- C、 一定温度下,增大n始(CO2):n始(H2)可提高CO2平衡转化率
- D、 研发高温高效催化剂可提高平衡时CH3OH的选择性
恒容密闭容器中, 与
与 在不同温度下发生反应:
在不同温度下发生反应: , 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
, 达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
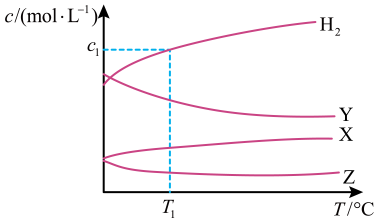
下列说法正确的是
- A、 该反应的平衡常数随温度升高而增大
- B、 曲线Y表示
随温度的变化关系
- C、 提高投料比
, 可提高
的平衡转化率
- D、 其他条件不变,
与
在
℃下反应,达到平衡时
对于反应 , 在温度一定时,平衡体系中
, 在温度一定时,平衡体系中 的体积分数
的体积分数 随压强的变化情况如图所示。下列说法中,正确的是
随压强的变化情况如图所示。下列说法中,正确的是

- A、 A,D两点对应状态的正反应速率大小关系:v(A)>v(D)
- B、 A,B,C,D,E各点对应状态中,v(正)<v(逆)的是E
- C、 维持
不变,E→A所需时间为
, 维持
不变,D→C所需时间为
, 则
- D、 欲使C状态沿平衡曲线到达A状态,从理论上,可由
无限缓慢降压至
达成