选择题
恒容密闭容器中,  在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )
在不同温度下达平衡时,各组分的物质的量(n)如图所示。下列说法正确的是( )
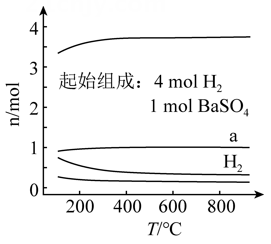
- A、 该反应的
- B、 a为
随温度的变化曲线
- C、 向平衡体系中充入惰性气体,平衡不移动
- D、 向平衡体系中加入
的平衡转化率增大
已知相同温度下,  。某温度下,饱和溶液中
。某温度下,饱和溶液中  、
、  、与
、与  的关系如图所示。
的关系如图所示。

下列说法正确的是( )
- A、 曲线①代表
的沉淀溶解曲线
- B、 该温度下
的
值为
- C、 加适量
固体可使溶液由a点变到b点
- D、
时两溶液中
常温下,向10mL0.1mol·L-1KCl溶液和10mL0.1mol·L-1K2CrO4溶液中分别滴加0.1mol·L-1AgNO3溶液。滴加过程中pM[表示-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为砖红色沉淀,下列说法不合理的是( )

- A、 bc所在曲线对应K2CrO4溶液
- B、 常温下,Ksp(Ag2CrO4)<Ksp(AgCl)
- C、 溶液中c(Ag+)的大小:a点>b点
- D、 用0.1mol·L-1AgNO3标准液滴定上述KCl、K2CrO4溶液时,Cl-先沉淀
下列图示与对应的叙述相符的是( )

- A、 图甲表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
- B、 图乙表示室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(
)的关系曲线,说明溶液中c(
)越大c(Ba2+)越小
- C、 图丙表示A、B两物质的溶解度随温度变化情况,将t1 ℃时A,B的饱和溶液分别升温至t2 ℃时,溶质的质量分数w(B)>w(A)
- D、 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)⇌N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
一定条件下,向体积为1L的密闭容器中充入1molCO2和4molH2 , 测得CO2和CH3OH(g)的浓度随时间的变化如图所示。下列叙述中正确的是( )

- A、 该反应的化学方程式为:CO2(g)+4H2(g)⇌2CH3OH(g)
- B、 10min时,反应停止
- C、 2min时,CO2的消耗速率等于CH3OH的消耗速率
- D、 从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L·min)
根据下列图示所得出的结论正确的是( )

- A、 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
- B、 图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
- C、 图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
- D、 图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
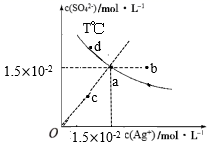
- A、 a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
- B、 a点溶液若降低温度,则a点可沿虚线移动到c点
- C、 向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
- D、 根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
下列图示与对应的叙述相符的是( )

- A、 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化
- B、 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液
- C、 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH
- D、 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
已知:用Pt﹣Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( )
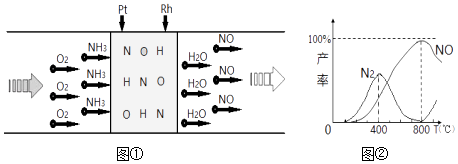
- A、 400℃时,生成的产物有N2、NO、H2O
- B、 800℃时,反应的化学方程式是:4NH3+5O2
4NO+6H2O
- C、 400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱
- D、 800℃以上,发生了反应:2NO(g)⇌O2(g)+N2(g)△H>0
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( )
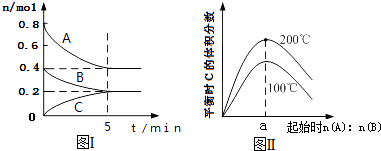
- A、 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L﹣1•min﹣1
- B、 图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2
- C、 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
- D、 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50%
下列图示与对应的叙述相符的是( )
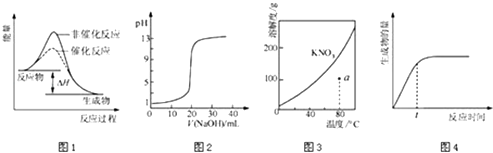
- A、 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
- B、 图2表示0.1000mol•L﹣1NaOH溶液滴定20.00mL0.1000mol•L﹣1CH3COOH溶液所得到的滴定曲线
- C、 图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
- D、 图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大












 △H1
△H1 △H2
△H2