选择题
二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是

- A、 海水酸化能引起
浓度增大、
浓度减小
- B、 海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
- C、 CO2能引起海水酸化,其原理为
 H++
H++ - D、 使用太阳能、氢能等新能源可改善珊瑚的生存环境
以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数  随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:  ]
]

下列叙述正确的是( )
- A、 曲线①代表
,曲线②代表
- B、 H2A溶液的浓度为0.2000 mol·L−1
- C、 HA−的电离常数Ka=1.0×10−2
- D、 滴定终点时,溶液中
某温度下,  和
和  的电离常数分别为
的电离常数分别为  和
和  。将
。将  和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其  随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

- A、 曲线Ⅰ代表
溶液
- B、 溶液中水的电离程度:b点>c点
- C、 从c点到d点,溶液中
保持不变(其中
、
分别代表相应的酸和酸根离子)
- D、 相同体积a点的两溶液分别与
恰好中和后,溶液中
相同
改变0.1mol•L﹣1二元弱酸H2A溶液的pH,溶液中的H2A、HA﹣、A2﹣的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)= ].下列叙述错误的是( )
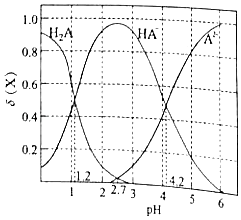
- A、 pH=1.2时,c(H2A)=c(HA﹣)
- B、 pH=4.2时,lg[K2(H2A)]=﹣4.2
- C、 pH=2.7时,c(HA﹣)>c(H2A)=c(A2﹣)
- D、 pH=4.2时,c(HA﹣)=c(A2﹣)=c(H2A)
已知: Ag+ +NH3 [Ag(NH3)]+ K1=103.32
[Ag(NH3)]+ K1=103.32
[Ag(NH3)]++NH3 [Ag(NH3)2]+ K2
Ag+、[Ag(NH3)]+、 [Ag(NH3)2]+ 的分布分数δ与lgc(NH3 )关系如下图所示,下列说法正确的是{例如:分布分数δ(Ag+)=}

- A、 曲线c代表[Ag(NH3)2]+
- B、 K2=10-3.61
- C、 [Ag(NH3)2]+
Ag++ 2NH3平衡常数K' =10-7.22
- D、 当c(NH3 )<0.01 mol/L时,c [Ag(NH3)2]+> c [Ag(NH3)]+>c(Ag+)

- A、 曲线I代表的微粒是
- B、 pH=7时,
- C、
- D、 b点时溶液中存在:
室温下,向10 mL0.1 mol·L-1 K2A(室温下,H2A的Ka1=1.64×10-3)溶液中滴加0.1 mol·L-1的HCl溶液,混合溶液的pH与所加HCl溶液体积的关系如图所示。下列说法正确的是
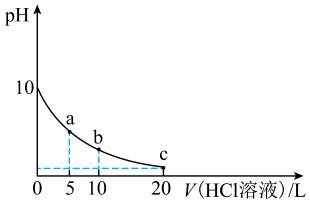
- A、 室温下,H2A的Ka2≈2.0 ×10-6
- B、 b点溶液存在关系式:c(K+)=c(Cl-)+c(HA- )+2c(A2- )
- C、 a、b、c点溶液中水的电离程度:a<b<c
- D、 a、b、c三点溶液均存在关系式:2[c(H2A)+c(HA- )+c(A2-)]=c(K+ )
牙齿表面由一层坚硬的、组成为Ca5(PO4)3OH的物质保护着,人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,向牙膏中添加NaHCO3、NaF均可增强护齿效果。已知:
物质 |
|
| |
下列说法正确的是
- A、
溶解
的离子方程式为:
- B、 牙膏中经常添加碳酸钙,主要是为了增加Ca2+浓度,抑制牙齿腐蚀
- C、 当
时,
可与
反应转化为
- D、 向牙膏中添加NaHCO3、NaF均可增强护齿效果,两者原理相同
室温下,甲、乙两烧杯均盛有20mLpH=4的醋酸溶液,向乙烧杯中加水稀释至pH=5,对此时两烧杯中溶液描述正确的是
- A、 溶液体积:10V甲>V乙
- B、 水电离出的H+浓度:c(H+)甲=10c(H+)乙
- C、 若分别用pH=10的NaOH溶液恰好完全中和,所得溶液的pH:甲>乙
- D、 若分别与10mLpH=10的NaOH溶液反应,所得溶液的pH:甲>乙
在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
- A、 中和时所需NaOH的量
- B、 溶液的导电能力
- C、 H+的物质的量
- D、 CH3COOH的物质的量
如图为某实验测得 溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法错误的是
溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法错误的是

- A、 ab段,
随温度升高而增大
- B、 a点溶液和d点溶液的
相同
- C、 a点时,
- D、 bc段可能发生反应:
将 溶液与0.1mol/LHCl溶液等体积混合(忽略温度变化),下列说法正确的是
溶液与0.1mol/LHCl溶液等体积混合(忽略温度变化),下列说法正确的是
- A、 混合溶液中
- B、 混合后
的水解常数增大
- C、 混合溶液中
- D、 混合后加入适量
固体,
的电离平衡向右移动
H3PO3是制造塑料稳定剂的原料。常温下,向100mL0.5mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中所有含磷微粒的物质的量分数(δ)与溶液pOH[pOH=-lgc(OH-)]的关系如图所示。下列说法错误的是

- A、 H3PO3的结构简式为

- B、 a点水电离出的c(OH-)=1×10-7.4mol·L-1
- C、 当pH=4时,c(HPO
)=c(H3PO3)
- D、 b点时加入NaOH溶液的体积为50mL
 )属于三元弱酸,其电离平衡常数的
)属于三元弱酸,其电离平衡常数的
- A、 a点时溶液中
的数量级为
- B、 b点溶液显酸性
- C、 c点溶液满足:
- D、
时,溶液满足:











