选择题
下图是亚砷酸As(OH)3和酒石酸 混合体系中部分物种的c-pH图(浓度:总As为
混合体系中部分物种的c-pH图(浓度:总As为 , 总T为
, 总T为 )。下列说法错误的是( )
)。下列说法错误的是( )

- A、
的
为
- B、
的酸性比
的强
- C、
时,
的浓度比
的高
- D、
时,溶液中浓度最高的物种为
常温下,一元酸 的
的 。在某体系中,
。在某体系中, 与
与 离子不能穿过隔膜,未电离的
离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。
可自由穿过该膜(如图所示)。

设溶液中 , 当达到平衡时,下列叙述正确的是( )
- A、 溶液Ⅰ中
- B、 溶液Ⅱ中的
的电离度
为
- C、 溶液Ⅰ和Ⅱ中的
不相等
- D、 溶液Ⅰ和Ⅱ中的
之比为
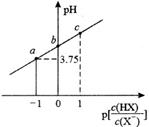
室温下,用0.1mol·L-1的NaOH溶液滴定20mL0.1mol·L-1HA溶液,测得混合溶液的pH与 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

- A、 导电能力:a>b
- B、 室温下,Ka(HA)=10-3.8
- C、 b点时,V(NaOH)=20mL
- D、 c点时,c(A-)>c(Na+)
常温下,通过滴加KOH溶液改变0.10mol/LK2Cr2O7溶液的pH时,各种含铬元素粒子浓度变化如图所示。下列说法正确的是

- A、 H2CrO4的K1=0.74
- B、 pH=4时,c(
)>c(
)>c(
)>c(H2CrO4)
- C、 反应
+ H2O
2
+ 2H+的平衡常数K= 1× 10-13.2
- D、 B点溶液中c(K+ )>2c(
)+3c(
)
25℃时,某二元弱碱M(OH)2的水溶液中含有M(OH)2、M(OH)+、M2+ , 它们的分布系数δ随溶液pH的变化曲线如图所示。Kb2为M(OH)2的第二步电离平衡常数,下列说法错误的是

- A、 Kb2=1×10-5.5
- B、 曲线II代表的微粒为M(OH)+
- C、 m、n、p三点对应的水溶液中,m点水的电离程度最小
- D、 0.1 mol·L-1 M(OH)Cl溶液中:c(Cl-)>c[M(OH)2]>c(M2+)>c(OH- )> >c(H+)
常温下,向1升 的NaClO溶液中缓慢通入
的NaClO溶液中缓慢通入 气体,使其充分吸收,溶液pH与通入
气体,使其充分吸收,溶液pH与通入 的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是
的物质的量关系如图所示(忽略溶液体积变化及NaClO、HClO的分解,以上发生的氧化还原反应均为不可逆反应)。下列说法错误的是

- A、 常温下,HClO电离平衡常数的数量级为
- B、 a点溶液中:
- C、 b点溶液中:
- D、 c点溶液中:

- A、 水的电离程度:
- B、
的数量级为
- C、 滴定至
点时,加入
溶液的体积为
- D、
点和
点的溶液中均存在
常温下, 和
和 溶液中含磷微粒的物质的量分数与溶液
溶液中含磷微粒的物质的量分数与溶液 的关系分别如图所示,向等物质的量浓度的
的关系分别如图所示,向等物质的量浓度的 和
和 混合溶液中加入适量的
混合溶液中加入适量的 溶液,下列说法错误的是
溶液,下列说法错误的是

- A、 由图可知
是二元酸
- B、
时,
- C、 常温下,
的反应平衡常数
- D、 溶液
由3变为6.6的过程中,水的电离程度增大
常温下,向一定浓度的H3PO3(亚磷酸, )溶液中滴加一定浓度的NaOH溶液或H2SO4溶液,溶液中lg
)溶液中滴加一定浓度的NaOH溶液或H2SO4溶液,溶液中lg 或lg
或lg 随溶液的pH的变化关系如图所示。下列叙述正确的是
随溶液的pH的变化关系如图所示。下列叙述正确的是
 )溶液中滴加一定浓度的NaOH溶液或H2SO4溶液,溶液中lg
)溶液中滴加一定浓度的NaOH溶液或H2SO4溶液,溶液中lg
- A、 直线b代表lg
与pH的关系
- B、 Y点溶液的pH=4.5
- C、 2H++HPO
H3PO3的平衡常数为108.1
- D、 pH=7时,c(Na+)>c(OH-)>c(HPO
)>c(H2PO
)
H2R为某二元有机弱酸。常温下,在保持c(HR-) =0.01 mol·L-1的Na2R和NaHR的混合溶液中,若用pR、pH2R表示-lgc(R2-)、-lg c( H2R) ,则不同溶液中的pR或pH2R与pH的关系曲线如图所示。下列说法中正确的是

- A、 XY所在的曲线是pR与pH的关系曲线
- B、 常温下,Ka2 (H2R)的数量级为10-5
- C、 Y点对应的pH =4.7
- D、 溶液中存在c(R2-) ·c(H2R) =10 -7
25℃时,某混合溶液中c(H2A) +c(HA-) +c(A2-) =0.01 mol/L,由水电离出的c水(H+) 的对数lgc水(H+ )与 、
、 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

- A、 Ka1(H2A) =10-8
- B、 Z点时溶液的pH=7
- C、 M点和N点溶液的组成完全相同
- D、 从X点到Y点发生的反应可能为:HA- +OH- =A2- +H2O