选择题
回收利用工业废气中的 和
和 , 实验原理示意图如下。
, 实验原理示意图如下。

下列说法不正确的是( )
- A、 废气中
排放到大气中会形成酸雨
- B、 装置
中溶液显碱性的原因是
的水解程度大于
的电离程度
- C、 装置
中溶液的作用是吸收废气中的
和
- D、 装置
中的总反应为
处理某铜冶金污水(含 )的部分流程如下:
)的部分流程如下:
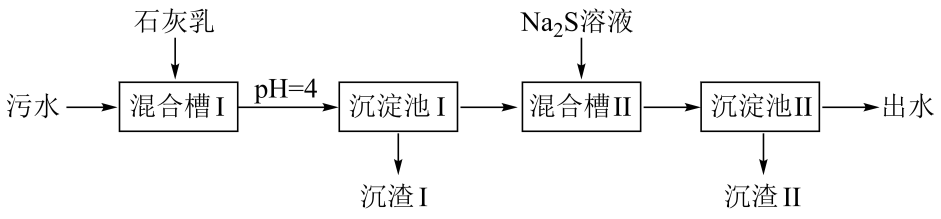
已知:①溶液中金属离子开始沉淀和完全沉淀的如下表所示:
| 物质 | | | | |
| 开始沉淀 | 1.9 | 4.2 | 6.2 | 3.5 |
| 完全沉淀 | 3.2 | 6.7 | 8.2 | 4.6 |
②。
下列说法错误的是
- A、 “沉渣Ⅰ”中含有
和
- B、
溶液呈碱性,其主要原因是
- C、 “沉淀池Ⅱ”中,当
和
完全沉淀时,溶液中
- D、 “出水”经阴离子交换树脂软化处理后,可用作工业冷却循环用水
某废水处理过程中始终保持H2S饱和,即 , 通过调节pH使
, 通过调节pH使 和
和 形成硫化物而分离,体系中
形成硫化物而分离,体系中 与
与 关系如下图所示,c为
关系如下图所示,c为 和
和 的浓度,单位为
的浓度,单位为 。已知
。已知 , 下列说法正确的是
, 下列说法正确的是

- A、
- B、 ③为
与
的关系曲线
- C、
- D、
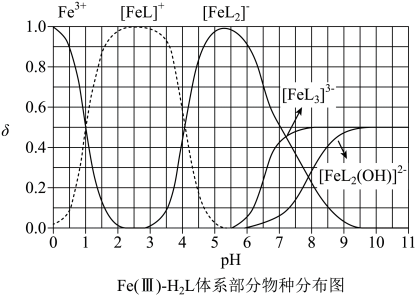
- A、 当
时,体系中
- B、 pH在9.5~10.5之间,含L的物种主要为
- C、
的平衡常数的lgK约为14
- D、 当
时,参与配位的
t℃时,向蒸馏水中不断加入NaA溶液,溶液中c2(OH-)与c(A-)的变化关系如图所示。下列叙述错误的是

- A、 当溶液中c(A-)=3×10-4mol/L时,有c(H+)=5×10-8mol/L
- B、 x点溶液中:c(Na+)>c(A-)>c(HA)
- C、 溶液中:c(HA)+c(H+)=c(OH-)
- D、 t℃=100℃
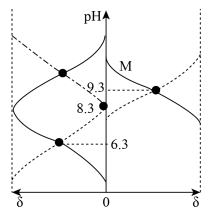
已知常温下水溶液中 、
、 、
、 、HB、
、HB、 的分布分数δ[如
的分布分数δ[如 ]随pH变化曲线如图1;溶液中
]随pH变化曲线如图1;溶液中 和
和 关系如图2.用
关系如图2.用
 溶液滴定20.00mL
溶液滴定20.00mL
 溶液,下列说法错误的是
溶液,下列说法错误的是

- A、 曲线d表示δ(HB)
- B、
的水解平衡常数
- C、 滴定过程中溶液会变浑浊
- D、 滴定过程中始终存在:
下列水溶液因水解而呈碱性的是( )
- A、 Na2CO3
- B、 BaCl2
- C、 (NH4)2SO4
- D、 Ca(OH)2
K2Cr2O7溶液中存在如下平衡:Cr2O 转化为CrO
转化为CrO
①Cr2O(aq)+H2O(l)
2HCrO
(aq) K1=3.0×10-2(25℃)
②HCrO(aq)
CrO
(ag)+H+(ag) K2=3.3×10-7(25℃)
25℃时,0.1mol/LK2Cr2O7溶液中lg随pH的变化关系如图。下列有关K2Cr2O7溶液的说法错误的是( )

- A、 加入过量烧碱溶液,反应的离子方程式为Cr2O
+2OH-=2CrO
+H2O
- B、 当pH=8.8时,c(CrO
)+c(Cr2O
)<0.10mo/L
- C、 加入少量水稀释,平衡时c2(CrO
)与c(Cr2O
)的比值增大
- D、 当pH=9.0时,溶液中HCrO
的平衡浓度约为6.0×10-4mol/L
常温下,将4.0g铁钉加入到30mL4%的 溶液中,一段时间后观察到铁钉表面产生气泡,氧气含量和溶液pH变化如下图所示。
溶液中,一段时间后观察到铁钉表面产生气泡,氧气含量和溶液pH变化如下图所示。

下列说法错误的是
- A、
溶液pH<7的原因:
- B、 铁钉表面产生气泡的原因:
- C、 加入铁钉消耗
,
水解平衡正向移动,产生
沉淀
- D、 推测溶液pH减小的原因:
下列符号表征错误的是
- A、
的水解方程式为:
- B、
分子中σ键的电子云轮廓图:

- C、
的VSEPR模型:

- D、
的形成过程:

已知MgF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节MgF2浊液的pH,测得在不同pH条件下,体系中−lgc(X)(X为Mg2+或F-)与lg 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

- A、 Ksp(MgF2)的数量级为10−9
- B、 L1代表−lgc(Mg2+)与lg
的变化曲线
- C、 a、c两点的溶液中均存在2c(Mg2+)<c(F-)+c(HF)
- D、 c点的溶液中存在c(Cl-)>c(Mg2+)>c(HF)>c(H+)
室温下,通过下列实验探究0.0100 mol∙L−1 Na2C2O4溶液的性质。
实验1:实验测得0.0100 mol∙L−1 Na2C2O4溶液的pH为8.6。
实验2:向溶液中滴加等体积、0.0100 mol∙L−1 HCl溶液,pH由8.6降为4.8。
实验3:向溶液中加入等体积、0.0200 mol∙L−1 CaCl2溶液,出现白色沉淀。
实验4:向稀硫酸酸化的KMnO4溶液中滴加Na2C2O4溶液至溶液褪色。
已知室温下Ksp(CaC2O4)=2.5×10−9 , 下列说法错误的是
- A、 0.0100 mol∙L−1 Na2C2O4溶液中满足:
>2
- B、 实验2滴加盐酸过程中可能存在:c(Na+ )=c(
)+2c(
)+c(Cl-)
- C、 实验3所得上层清液中:c(
)=5×10−7 mol·L−1
- D、 实验4发生反应的离子方程式为
+4
+12H+=2CO2 ↑+4Mn2+ +6H2O
NH4HCO3是我国除尿素外使用最广泛的一种氮肥产品,还用作缓冲剂、充气剂和分析试剂。常温下,0.1mol·L-1NH4HCO3溶液pH是7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是

- A、 pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,
和
浓度逐渐减小
- B、 NH4HCO3溶液中:c(NH3 ·H2O) + c(
) >c(H2CO3)
- C、 分析可知,常温下水解平衡常数Kh(
)的数量级为10-7
- D、 常温下,
= 10-16.8
某化学兴趣小组测定了 溶液的pH随温度的变化,结果如下图所示。下列叙述正确的是
溶液的pH随温度的变化,结果如下图所示。下列叙述正确的是

- A、
溶液呈碱性的原因是
- B、
溶液中:
- C、 图1表明升温过程中
溶液水解程度减小,pH减小
- D、 由图2可推知降低温度时,水的电离平衡逆向移动



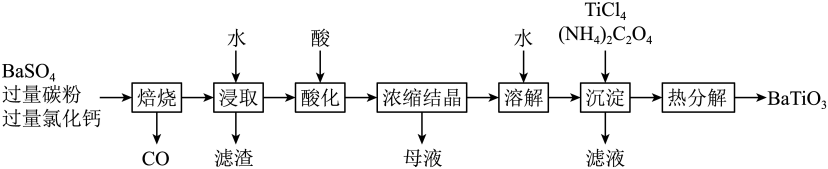


 已知:
已知: 
 已知:①酸解后,钛主要以TiOSO4形式存在。强电解质TiOSO4在溶液中仅能电离出SO
已知:①酸解后,钛主要以TiOSO4形式存在。强电解质TiOSO4在溶液中仅能电离出SO