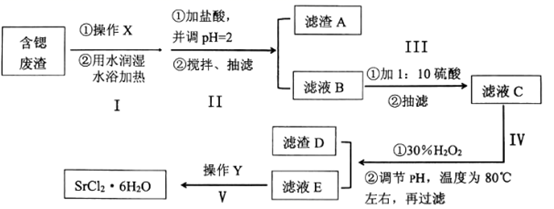
选择题
25℃时,下列各组离子中可以在水溶液中大量共存的是( )
- A、
、
、
、
- B、
、
、
、
- C、
、
、
、
- D、
、
、
、
下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO 等离子大量共存的是( )
等离子大量共存的是( )
- A、 加入ZnSO4
- B、 加入Fe粉
- C、 通入NH3
- D、 通入CO2
下列各组离子在给定溶液中能大量共存的是( )
- A、 在
氨水中:
- B、 在
氯化钠溶液中:
- C、 在
醋酸溶液中:
- D、 在
硝酸银溶液中:
常温下,下列各组离子在给定溶液中能大量共存的是( )
- A、 pH=1的溶液:Fe2+、Mg2+、
、
- B、 pH=12的溶液:K+、Na+、
、
- C、 pH=7的溶液:Na+、Cu2+、S2-、Cl-
- D、 pH=7的溶液:Al3+、K+、Cl-、
对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
| 粒子组 | 判断和分析 | |
| A | | 不能大量共存,因发生反应: |
| B | | 不能大量共存,因发生反应: |
| C | | 能大量共存,粒子间不反应 |
| D | | 能大量共存,粒子间不反应 |
- A、 A
- B、 B
- C、 C
- D、 D
下列各组离子在溶液中能大量共存,加入氢氧化钠溶液有沉淀生成,加入盐酸有气体生成的一组离子是( )
- A、
、Na+ 、Ba2+、
- B、 K+、Mg2+ 、Cl- 、
- C、
、
、
、Na+
- D、
、Cl- 、
、K+
常温下,下列各组离子一定能在指定溶液中大量共存的是
- A、 加入铝产生氢气的溶液:
- B、 澄清透明的溶液:
- C、 能使甲基橙试液显红色的溶液:
- D、 水电离的
的溶液:
室温时,下列各组离子在水溶液中可以大量共存的是
- A、
、
、
、
- B、
、
、
、
- C、
、
、
、
- D、
、
、
、
室温下,经指定操作后,下列各组溶液中离子还能大量共存的是
- A、 加入
:
、
、
、
- B、 加入
:
、
、
、
- C、 加入
:
、
、
、
- D、 加入
:
、
、
、
现有一澄清透明的溶液,可能含有大量的Fe3+、Fe2+、Al3+、H+、AlO 、CO
、CO 、NO
、NO 七种离子中的几种,向该溶液中逐滴加入1mol•L-1NaOH溶液一定体积后才产生沉淀,则下列判断正确的是
七种离子中的几种,向该溶液中逐滴加入1mol•L-1NaOH溶液一定体积后才产生沉淀,则下列判断正确的是
- A、 溶液中可能含有Fe2+
- B、 溶液中一定含有NO
- C、 溶液中可能含有CO
- D、 溶液中一定不含Al3+
常温下,下列指定溶液中,各组离子一定能大量共存的是( )
- A、
的溶液:
、
、
、
- B、
溶液:
、
、
、
- C、 甲基橙为黄色的溶液:
、
、
、
- D、
的溶液:
、
、
、
室温时,下列各组离子在水溶液中可以大量共存的是( )
- A、
、
、
、
- B、
、
、
、
- C、
、
、
、
- D、
、
、
、
常温下,下列各组离子在指定溶液中能大量共存的是
- A、 澄清透明的溶液中:
、
、
、
- B、 能使酚酞变红的溶液中:
、
、
、
- C、 麦芽糖溶液中:
、
、
、
- D、 含
的溶液中:
、
、
、
下列有关Fe2(SO4)3溶液的叙述正确的是
- A、 该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存
- B、 和KI溶液反应的离子方程式:Fe3++2I-=Fe2++I2
- C、 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-=Fe(OH)3↓+ BaSO4↓
- D、 1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe

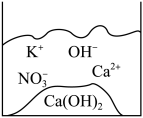


 下列说法错误的是( )
下列说法错误的是( )