选择题
一种钠盐的结晶水合物的阴离子由短周期元素X、Y、Z组成,其结构如图,已知:Z为第二周期元素,三种元素原子序数之和小于20,下列说法正确的是
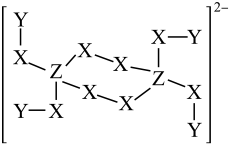
- A、 X、Y、Z三种元素中原子半径最大的是X
- B、 NaZY4是一种强还原剂,其固体溶于水可产生Y2
- C、 Z原子的L层上有5个电子
- D、 X的氢化物中不可能存在非极性共价键
在“石蜡 →石蜡油 →石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是
- A、 范德华力、范德华力、范德华力
- B、 共价键、共价键、共价键
- C、 范德华力、共价键、共价键
- D、 范德华力、范德华力、共价键
下列变化过程中有化学键被破坏的是( )
- A、 碘升华
- B、 浓硫酸稀释
- C、 蔗糖溶于水
- D、 浓盐酸稀释
下列说法错误的是( )
- A、 淀粉和葡萄糖互为同系物
- B、 氨基酸能与酸、碱反应生成盐
- C、 乙醛和乙酸可用NaHCO3溶液进行鉴别
- D、 氢键是一种分子间作用力
下列过程只需要破坏共价键的是( )
- A、 晶体硅熔化
- B、 碘升华
- C、 熔融Al2O3
- D、 NaCl溶于水
干冰气化过程中发生变化的是( )
- A、 分子间作用力
- B、 分子内共价键的极性
- C、 分子内原子间距离
- D、 分子的空间构型
下列说法不正确的是( )
- A、 CO2、SiO2的晶体结构类型不同
- B、 加热硅、硫晶体使之熔化,克服的作用力不同
- C、 HCl、NaCl溶于水,破坏的化学键类型相同
- D、 NaOH,NH4Cl晶体中既有离子键又有共价键
科学家将石墨在氟磺酸中“溶解”制得石墨烯(即单层石墨),该溶解克服了石墨层与层之间的( )
- A、 范德华力
- B、 离子键
- C、 共价键
- D、 金属键
化学键是非常重要的概念,它与物质变化过程中的能量变化息息相关,下列说法正确的是
- A、 氢键是化学键中的一种,会影响物质的熔沸点
- B、 活泼金属元素与活泼非金属元素一定形成离子键
- C、 速滑馆“冰丝带”用干冰作为制冷剂,干冰升华过程中破坏了共价键
- D、 物理变化也可以有化学键的破坏
下列说法正确的是
- A、 HCl比H2S稳定是因为分子间作用力前者强于后者
- B、 BF3、SiCl4中,每个原子都满足8电子稳定结构
- C、 CaF2和NaH中的化学键类型完全相同
- D、 工业上用钠单质与TiCl4溶液反应制取钛单质
下列说法不正确的是( )
- A、 HF比H2O稳定性更强,是由于HF分子间作用力较大
- B、 CCl4和N2分子晶体中各原子最外层都达到8电子稳定结构
- C、 Na投入到水中,有共价键的断裂与形成
- D、 离子化合物中一定含有离子键,可能含有共价键
下列说法正确的是( )
- A、 CH4、CCl4都是含有极性键的极性分子
- B、
与NH3、H3O+的空间结构均为三角锥形
- C、 CS2、H2O、C2H2都是直线形分子
- D、 分子中共价键的键能越大,分子的熔、沸点越高
下列说法正确的是( )
- A、
分子中
键与
键个数比为1∶1
- B、
的稳定性高,是因为水分子间存在氢键
- C、 键长等于成键两原子的半径之和
- D、 分子之间可能存在化学键
下列关于化学键的说法中,不正确的是( )
- A、 化学反应过程包含反应物中化学键断裂和生成物中化学键形成
- B、 氯化氢气体溶解于水产生氢离子和氯离子的过程中有共价键被破坏
- C、 化学键是相邻原子或离子间强烈相互作用
- D、 氢键属于一种化学键
关于化学键的叙述中,下列说法正确的是( )
- A、 化学键存在于相邻原子之间,也存在于相邻分子之间
- B、 NaHSO4固体中含有的阳离子与阴离子的个数比为1∶1
- C、 阴、阳离子间通过静电引力所形成的化学键是离子键
- D、 不同元素组成的多原子分子中的化学键一定全是极性键
下列变化需克服相同类型作用力的是( )
- A、 碘和干冰的升华
- B、 硅和冰的熔化
- C、 氯化氢和氯化钾的溶解
- D、 溴和汞的气化
下列说法正确的是( )
- A、
晶体溶于水时,离子键被破坏,共价键不受影响
- B、 氢化物稳定性比较:
;酸性比较:
- C、
的热稳定性小于
- D、
易分解是因为
分子间作用力弱
随着科学技术的不断进步,研究物质的手段和途径越来越多, 、
、 、
、 、
、 等己被发现。下列有关说法中,正确的是( )
等己被发现。下列有关说法中,正确的是( )
- A、
与
中存在氢键
- B、
与
互为同位素
- C、
分子中有范德华力
- D、 1个
中含有24个价电子
下列说法中正确的是:( )
- A、 分子晶体中一定含有分子间作用力,可能有共价键
- B、 含有极性键的分子一定是极性分子
- C、 只要含有金属阳离子的晶体就一定是离子晶体
- D、 金属晶体的熔点一定比分子晶体的高
在下列各组物质中,化学键类型完全相同的是( )
- A、 Cl2 和 CaCl2
- B、 H2O2 和 Na2O2
- C、 CO2 和 Ar
- D、 NaCl 和 Na2O
下列说法正确的是( )
- A、 由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
- B、 HF的沸点在同族元素的氢化物中出现反常,是因为HF分子内存在氢键
- C、 F2、Cl2、Br2、I2熔沸点逐渐升高,是因为它们的组成结构相似,分子间的范德华力增大
- D、 氢氧化钠固体溶于水破坏了共价键
共价键、离子键和分子间作用力是微粒之间的三种作用力,现有晶体:①  ;②
;②  ;③
;③  ;④白磷(P4);⑤NaCl;⑥金刚石;⑦石墨。其中含有两种作用力的是( )
;④白磷(P4);⑤NaCl;⑥金刚石;⑦石墨。其中含有两种作用力的是( )
- A、 ①②④⑥
- B、 ①②③⑥
- C、 ②④⑤⑥
- D、 ①③④⑦
