选择题
用电石(主要成分为CaC2 , 含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析错误的是( )
- A、 CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O=Ca(OH)2+H2S↑、Ca3P2+6H2O=3Ca(OH)2+2PH3↑
- B、 不能依据反应①比较硫酸与氢硫酸的酸性强弱
- C、 反应②中每24 mol CuSO4氧化11 mol PH3
- D、 用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰
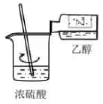
下列实验操作或装置能达到目的的是( )
| A | B | C | D |
| | | | |
| 混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 | 证明乙炔可使溴水褪色 |
- A、 A
- B、 B
- C、 C
- D、 D
丙炔和氯化氢之间发生加成反应,产物不可能是( )
- A、 1-氯丙烷
- B、 1,2-二氯丙烷
- C、 1-氯丙烯
- D、 2-氯丙烯
如图所示是实验室制取乙炔及性质检验装置,下列说法正确的是( )

- A、 ①只能是饱和食盐水
- B、 ②的作用是吸收SO2 , 排除干扰
- C、 ③和④的褪色原理相同
- D、 乙炔点燃前要检验纯度
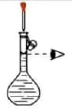
用下列装置进行实验,能达到实验目的的是( )

- A、 用装置甲制备NaHCO3晶体
- B、 用装置乙证明乙炔可使溴水褪色
- C、 用装置丙分离苯和溴苯
- D、 用装置丁测定KMnO4溶液的物质的量浓度
实验室制备乙烯和乙炔的叙述错误的是( )
- A、 都不能用启普发生器
- B、 都需要温度计指示反应温度
- C、 都能用碱石灰除去产物中的酸性气体
- D、 都不能直接用溴水检验产物
室温时用下列实验装置进行相应实验,能达到目的的是( )

- A、 制取乙酸丁酯
- B、 验证乙炔的还原性
- C、 验证浓硫酸具有强氧化性
- D、 分离乙酸乙酯与碳酸钠溶液
下列实验仪器或装置的选择正确的是( )
| A | B | C | D |
| | | | |
| 收集 CO2 | 除去Cl2 中的 HCl | 配制 20.00mL0.1 mol∙L−1Na2CO3溶液 | 制取乙炔 |
- A、 A
- B、 B
- C、 C
- D、 D
利用下列装置进行实验,能达到实验目的的是( )
| A | B | C | D |
| | | | |
| 分离乙醇与乙酸 | 模拟外加电流的阴极保护法 | 证明 | 证明乙炔可使溴水褪色 |
- A、 A
- B、 B
- C、 C
- D、 D
2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如图所示),其特殊的电子结构将有望广泛应用于电子材料领域。下列说法错误的是( )
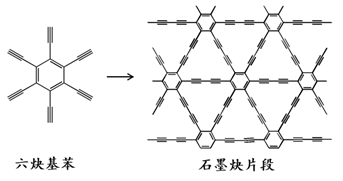
- A、 六炔基苯的化学式为C18H6
- B、 六炔基苯和石墨炔都具有平面型结构
- C、 六炔基苯和石墨炔都可发生加成反应
- D、 六炔基苯合成石墨炔属于加聚反应
在给定条件下,下列选项所示的物质间转化均能实现的是( )
- A、 MgCl2(熔融)
Mg(s)
MgO(s)
- B、 CaC2(s)
C2H4(g)

- C、 FeS2(s)
SO2(g)
(NH4)2SO4(aq)
- D、 Al(OH)3(s)
NaAlO2(aq)
AlCl3(aq)
下列关于饱和食盐水的用途或装置设计错误的是( )
- A、
 模拟工业制纯碱
模拟工业制纯碱 - B、
 甲烷的取代反应
甲烷的取代反应 - C、
 实验室制乙炔
实验室制乙炔 - D、
 除去氯气中的氯化氢
除去氯气中的氯化氢
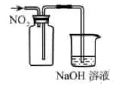
下列实验方案能达到实验目的的是( )
| | | | |
| A.从溴水中提取溴 | B.验证乙炔的还原性 | C.制取并收集NO2 | D.实验室制取溴苯 |
- A、 A
- B、 B
- C、 C
- D、 D
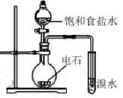
下图为实验室制取乙炔并验证其性质的实验装置(夹持装置己略去)。下列说法正确的是( )

- A、 用饱和食盐水替代水的目的是加快反应速率
- B、 CuSO4溶液的作用是除去杂质
- C、 酸性KMnO4溶液褪色说明乙炔具有漂白性
- D、 可用向上排空气法收集乙炔
科学家合成的一种纳米小人结构如下图。下列关于该化合物的说法正确的是( )

- A、 易溶于水
- B、 1 mol该物质最多可与16 mol H2发生加成反应
- C、 一氯代物有10种(不考虑空间异构)
- D、 所有原子处于同一平面
与H2反应生成 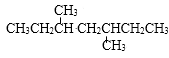 的单炔烃有( )
的单炔烃有( )
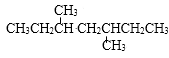 的单炔烃有( )
的单炔烃有( )- A、 1种
- B、 2种
- C、 4种
- D、 8种
图为实验室制乙炔的装置。下列说法错误的是( )

- A、 分液漏斗中可以装饱和食盐水
- B、 制出的乙炔常有臭味
- C、 洗气瓶中的溴水褪色
- D、 点燃时观察到淡蓝色火焰
下列实验方案,能达到相应实验目的的是( )
实验目的 | A.探究铁钉发生析氢腐蚀 | B.验证溴乙烷发生消去反应 | C.对比Fe3+与Cu2+的氧化能力强弱 | D.探究乙炔的性质 |
实验方案 |
|
|
|
|
- A、 A
- B、 B
- C、 C
- D、 D
下列关于有机化合物的说法正确的是( )
- A、 分子式为C3H6Cl2的有机物有4种同分异构体(不考虑立体异构)
- B、
 和
和  互为同系物
互为同系物 - C、 乙炔和溴的四氯化碳溶液反应生成1,2-二溴乙烷
- D、 甲苯分子中所有原子都在同一平面上




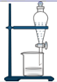













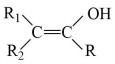
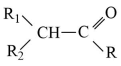
 (R、R1、R2为H或烃基)
(R、R1、R2为H或烃基) +H2O
+H2O







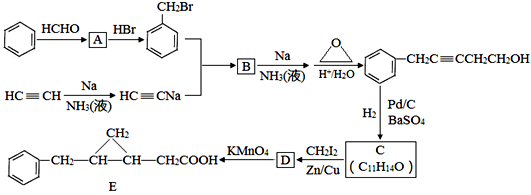
 已知:①
已知:①