选择题
下列玻璃仪器在相应实验中选用不合理的是

- A、 重结晶法提纯苯甲酸:①②③
- B、 蒸馏法分离CH2Cl2和CCl4:③⑤⑥
- C、 浓硫酸催化乙醇制备乙烯:③⑤
- D、 酸碱滴定法测定NaOH溶液浓度:④⑥
利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:
![]()
下列操作错误的是
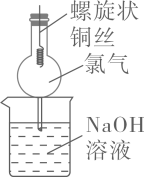
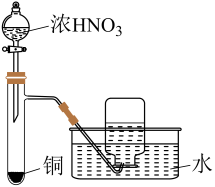
- A、 红磷使用前洗涤以除去表面杂质
- B、 将红磷转入装置,抽真空后加热外管以去除水和氧气
- C、 从a口通入冷凝水,升温使红磷转化
- D、 冷凝管外壁出现白磷,冷却后在氮气氛围下收集
下列装置可以用于相应实验的是
| A | B | C | D |
|
|
|
|
|
| 制备 | 分离乙醇和乙酸 | 验证 | 测量 |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验操作中选用仪器正确的是( )
|
|
|
|
用量筒量取10.00mL盐酸 | 用瓷坩埚加热熔化NaOH固体 | 用分液漏斗分离乙酸异戊酯和水的混合物 | 配制一定温度的NaCl饱和溶液,用温度计测温并搅拌 |
A | B | C | D |
- A、 A
- B、 B
- C、 C
- D、 D
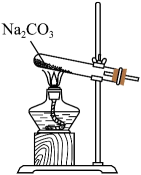
某实验小组用如下实验用品检验黑木耳中铁元素。下列说法错误的是( )

- A、 将黑木耳灼烧灰化,选用的仪器有①、②、⑥、⑦和⑨
- B、 用浓硝酸溶解木耳灰并获得滤液,选用的仪器有④、⑤、⑦和⑩
- C、 检验滤液中的
, 选用③、⑧和⑩
- D、 利用上述仪器也可进行硫酸铜结晶水含量的测定
从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是

- A、 海带灼烧灰化,选用①②⑧
- B、 加水浸泡加热,选用②④⑦
- C、 过滤得到滤液,选用④⑤⑦
- D、 萃取和分液,选用③④⑥
下列关于仪器使用的说法正确的是( )

- A、 a可用于溶液的蒸发浓缩
- B、 b可用于物质分离
- C、 c受热时不需要垫石棉网
- D、 d通冷凝水的方向是上进下出
实验室利用下列仪器(不考虑夹持装置和塞子及导管)不能制备的气体是( )

- A、 C2H2
- B、 H2
- C、 CO2
- D、 C2H4
掌握化学实验技能是进行科学探究的基本保证。下列有关说法正确的是
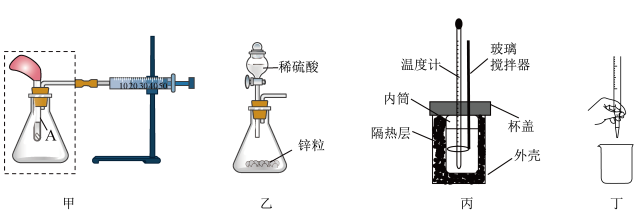
- A、 若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好
- B、 将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应
- C、 用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中
- D、 丁装置是排出碱式滴定管中的气泡操作
下列实验操作或实验仪器的使用正确的是
- A、 做“海带中碘元素的分离及检验”实验时,须用过量的氯气或双氧水氧化I-
- B、 用剩的药品能否放回原瓶,应视具体情况而定
- C、 其他条件相同时,双氧水在碱性溶液中分解速率比在酸性溶液中慢
- D、 滴定接近终点时,滴定管的尖嘴不能接触锥形瓶内壁
实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析错误的是

- A、 使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
- B、 用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生
- C、 该改进装置可用于
性质的探究实验
- D、 利用此装置可较长时间看到白色絮状沉淀
下列实验装置及表述正确的是
A | B | C | D |
|
|
|
(经酸化3%NaCl溶液) |
蒸干AlCl3溶液制无水AlCl3固体 | 实验室制乙炔 | 实验室制备Fe(OH)3胶体 | 在Fe表面生成蓝色沉淀,无法验证Zn保护了Fe |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验中,所选装置(可添加试剂,可重复使用)不合理的是

- A、 盛放NaOH溶液,选用③
- B、 用NH4Cl和Ca(OH)2固体制备氨,选用②
- C、 配制100mL1.00mol•L-1NaCl溶液,选用⑤
- D、 用大理石和盐酸制取CO2并比较碳酸和苯酚的酸性强弱,选用①④
甲~丁图为中学化学常用仪器的全部或局部,下列说法正确的是
|
|
|
|
甲 | 乙 | 丙 | 丁 |
- A、 甲图所示仪器使用前需检查是否漏水
- B、 乙图所示仪器用于蒸馏时,冷却水应从下口通入
- C、 丙图所示仪器用于观察氯化钠的焰色试验
- D、 丁图所示仪器可用于酸碱中和滴定和减压过滤
下列有关实验操作的叙述错误的是
- A、 滴定管用水洗净后,加入待装液
- B、 配制溶液时,容量瓶不需干燥
- C、 测结晶水含量时,加热后的坩埚必须放在干燥器中冷却
- D、 过滤操作中,漏斗的尖端应接触烧杯内壁
实验室制备下列物质不需要用到酒精灯的是
- A、 乙烯
- B、 乙炔
- C、 乙酸乙酯
- D、 乙酸丁酯
下列实验操作规范的是

- A、 ①灼烧干海带
- B、 ②检验铜与浓硫酸反应的氧化产物
- C、 ③用
萃取碘水中的碘,振荡、放气
- D、 ④配制溶液定容后摇匀
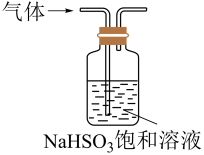
球形干燥管是中学化学常用的一种玻璃仪器。下列有关球形干燥管的创新用途,错误的是
选项 | A | B | C | D |
装置 |
|
|
|
|
用途 | 用于尾气处理,防倒吸 | 用于铜丝与Cl2反应,防污染 | 简易的天 然水净化过滤器 | 用Na2CO3固体与稀硫酸反应制备CO2气体,可随制随停 |
- A、 A
- B、 B
- C、 C
- D、 D
下列有关实验方法正确的是
- A、 用X射线衍射实验可获得青蒿素分子的结构
- B、 用广泛pH试纸测得醋酸溶液的pH为2.0
- C、 用淀粉溶液检验海水中的碘元素
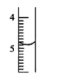
- D、 用25 mL碱式滴定管量取16.60 mL高锰酸钾溶液
下列叙述正确的是
- A、 容量瓶、滴定管、分液漏斗使用前均需要检验是否漏水
- B、 可用氢氟酸清洗做过硅酸分解实验的瓷坩埚
- C、 金属镁着火时,可用泡沫灭火器灭火
- D、 可将硝酸银固体保存在棕色细口瓶中
化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是
- A、 用湿润的蓝色石蕊试纸检验
- B、 中学实验室中,可将未用完的钠放回原试剂瓶
- C、 进行焰色试验时,可用玻璃棒替代铂丝
- D、 酸碱中和滴定实验中,应先用待测液润洗锥形瓶
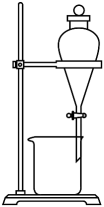
欲分离某CCl4和H2O的混合液,需要用到的仪器是
- A、

- B、

- C、
- D、

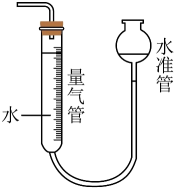
下列仪器可加热的是
- A、

- B、

- C、

- D、

下列实验操作规范且能达到实验目的的是( )
选项 | A | B | C | D |
操作 |
|
|
|
|
实验目的 | 制备氢氧化铁胶体 | 定容 | 除去 | 制备并收集 |
- A、 A
- B、 B
- C、 C
- D、 D
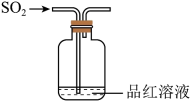
下列实验装置及操作均合理的是( )

- A、 用装置甲测定污水样品中
- B、 用装置乙制备乙酸乙酯
- C、 用装置丙灼烧海带
- D、 用装置丁测定中和热