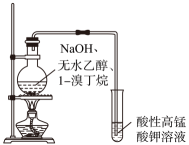
选择题
一定条件下,乙酸酐 醇解反应
醇解反应 可进行完全,利用此反应定量测定有机醇
可进行完全,利用此反应定量测定有机醇 中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
中的羟基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐-苯溶液。
②量取一定体积乙酸酐-苯溶液置于锥形瓶中,加入样品,充分反应后,加适量水使剩余乙酸酐完全水解:
。
③加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液
。
④在相同条件下,量取相同体积的乙酸酐-苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用甲醇标准溶液滴定至终点,消耗标准溶液
。对于上述实验,下列做法正确的是
- A、 进行容量瓶检漏时,倒置一次即可
- B、 滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点
- C、 滴定读数时,应单手持滴定管上端并保持其自然垂直
- D、 滴定读数时,应双手一上一下持滴定管
下列说法不正确的是( )
- A、 用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
- B、 铝热反应非常剧烈,操作时要戴上石棉手套和护目镜
- C、 利用红外光谱法可以初步判断有机物中具有哪些基团
- D、 蒸发浓缩硫酸铵和硫酸亚铁(等物质的量)的混合溶液至出现晶膜,静置冷却,析出硫酸亚铁铵晶体
化学实验操作是进行科学实验的基础。下列操作符合规范的是( )
|
|
|
|
|
| A.碱式滴定管排气泡 | B.溶液加热 | C.试剂存放 | D.溶液滴加 |
- A、 A
- B、 B
- C、 C
- D、 D
下列图示装置能达到实验目的的是
A | B | C | D |
|
|
|
|
碱式滴定管排气泡 | 分离碘单质 | 验证1-溴丁烷发生消去反应的产物中有1-丁烯 | 从 |
- A、 A
- B、 B
- C、 C
- D、 D
下列关于实验操作的描述正确的是( )
- A、 氧化还原反应滴定时,用酸式滴定管盛装
标准溶液
- B、 从食盐水中得到
晶体,当坩埚中出现大量固体时,停止加热,利用余热蒸干
- C、 用苯萃取溴水中的
, 分离时溴和苯的混合溶液从分液漏斗下口放出
- D、 配制一定物质的量浓度溶液时,将量取好的物质放入容量瓶中,加水溶解至刻度线
下列设计的实验装置或方案不能达到相应实验目的的是( )

- A、 利用图
装置探究乙醇的还原性
- B、 利用图
装置比较
的催化效果好于
- C、 利用图
装置从
溶液中提取
晶体
- D、 利用图
装置量取
的稀盐酸
下列与实验相关的操作或方案正确的是( )
| A.配制一定物质的量浓度的溶液 | B.排去碱式滴定管内的气泡 | C.收集纯净的氯气 | D.吸收尾气中的SO2 |
| | | | |
- A、 A
- B、 B
- C、 C
- D、 D
测定水的总硬度一般采用配位滴定法,即在pH=10的氨性溶液中,以铬黑  作为指示剂,用EDTA(乙二胺四乙酸)标准溶液直接滴定水中的Ca2+、Mg2+测定中涉及的反应有:①M2+(金属离子)+Y4-(EDTA)=MY2-;
作为指示剂,用EDTA(乙二胺四乙酸)标准溶液直接滴定水中的Ca2+、Mg2+测定中涉及的反应有:①M2+(金属离子)+Y4-(EDTA)=MY2-;
②M2++EBT(铬黑T,蓝色)=MEBT(酒红色);
③MEBT+Y4-(EDTA)=MY2-+EBT。下列说法正确的是( )
- A、 配合物MEBT的稳定性大于MY2-
- B、 在滴定过程中眼睛要随时观察滴定管中液面的变化
- C、 达到滴定终点的现象是溶液恰好由酒红色变为蓝色,且半分钟内不恢复原色
- D、 实验时装有EDTA标准液的滴定管只用蒸馏水洗涤而未用标准液润洗,测定结果将偏小
用滴定法测定含有少量NaCl的小苏打固体中NaHCO3的质量分数,所用标准盐酸的浓度为0.1000 mol/L。有关叙述正确的是( )
- A、 用量筒配制100 mL待测液
- B、 滴定前用待测液润洗锥形瓶
- C、 当滴至指示剂变色并能将该颜色保持半分钟即为滴定终点
- D、 装标准液前未用标准盐酸润洗滴定管,会造成实验结果偏低
下列有关实验操作的说法正确是( )
- A、 向饱和氯化钠溶液中先通入过量二氧化碳再通入氨气,可制得大量碳酸氢钠固体
- B、 为了减小实验误差,烧杯、锥形瓶和容量瓶等仪器应洗涤干净,必须烘干后使用
- C、 将含有少量乙烯的甲烷气体依次通过足量酸性高锰酸钾溶液、足量碱石灰,可除去甲烷中的乙烯杂质
- D、 中和滴定实验中滴定管中液体流速宜先快后慢,滴定时眼睛注视着滴定管中液体刻度的变化
探究浓硫酸和铜的反应,下列装置或操作正确的是( )

- A、 用装置甲进行铜和浓硫酸的反应
- B、 用装置乙收集二氧化硫并吸收尾气
- C、 用装置丙稀释反应后的混合液
- D、 用装置丁测定余酸的浓度
下列有关滴定的说法正确的是( )
- A、 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
- B、 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
- C、 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为
mol/L
- D、 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
用0.0100mol/L的KMnO4标准溶液滴定某未知浓度的H2C2O4溶液,下列说法错误的是( )
- A、 该滴定实验不需要指示剂
- B、 该实验用到的玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶
- C、 滴定管使用前需检验是否漏液
- D、 若滴定终止时,仰视读数,所测H2C2O4浓度偏高
下列实验操作规范、能达到实验目的的是( )
- A、 用乙醇作萃取剂萃取碘水中的碘
- B、 将NO2球放在不同温度的水中探究温度对化学反应速率的影响
- C、 从海带中提取碘应在烧杯中灼烧海带并用玻璃棒搅拌
- D、 用酸式滴定管量取25.00mL0.1000mol/L的HCl溶液