选择题
下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水 | 萃取碘水中的碘 | 分离粗盐中的不溶物 | 由 |
|
|
|
|
A | B | C | D |
- A、 A
- B、 B
- C、 C
- D、 D
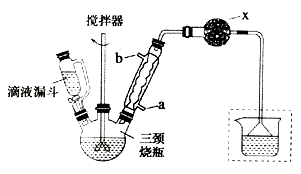
蒸馏操作中需要用到的仪器是( )
- A、
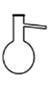
- B、

- C、
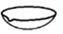
- D、
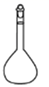
下列实验操作不当的是
- A、 用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
- B、 用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
- C、 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
- D、 常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
下列最适合分离己烷和辛烷的混合物的技术是( )
- A、 过滤
- B、 纸层析法
- C、 萃取
- D、 蒸馏
下列实验操作或装置正确的是

- A、 用甲装置分离苯和溴苯的混合液
- B、 用乙装置进行氢氧化钠滴定盐酸的实验,测定盐酸的浓度
- C、 用丙装置制备无水氯化镁
- D、 用丁装置进行中和热的测定
岭南文化源远流长。下列说法错误的是
- A、 客家围屋建造过程中用作黏稠剂的糯米和鸡蛋清都属于混合物
- B、 云浮云石在粗雕、细刻过程中发生了物理变化
- C、 制作粤绣所用的孔雀毛和马尾的主要成分都是纤维素
- D、 “南粤佳酿”长乐烧在生产过程中需要用到蒸馏操作
下列叙述错误的是
- A、 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
- B、 取浓度均为
的草酸钠和
溶液,草酸钠溶液
较大,表明草酸是弱酸
- C、 蒸馏完毕后,应先停止加热,待装置冷却后,停止通冷却水,再拆卸蒸馏装置
- D、 向酸性
溶液中加入
粉末,紫色褪去,证明
中含
(II)
下列装置或操作能达到实验目的是( )
|
|
|
|
A.除去乙醇中的乙酸 | B.形成原电池 | C.制取乙酸乙酯 | D.石油的蒸馏 |
- A、 A
- B、 B
- C、 C
- D、 D
用下列装置完成相关实验,不合理的是( )

- A、 用a配制100mL1.00mol·L-1NaCl溶液
- B、 用b制备少量乙酸乙酯
- C、 用c蒸馏海水得到淡水
- D、 用d分离Na2CO3溶液与CH3COOC2H5
现有三组混合溶液:①乙酸乙酯和乙酸钠溶液;②丁醇和乙醇;③溴化钠和单质溴的水溶液。分离以上各混合液的正确方法依次是( )
- A、 分液、萃取、蒸馏
- B、 萃取、蒸馏、分液
- C、 分液、蒸馏、萃取
- D、 蒸馏、萃取、分液
硝基苯在有机合成工业中有广泛应用,实验室利用苯和浓硝酸合成硝基苯并分离提纯的过程如下:反应→静置→分液→纯碱洗→水洗→干燥→蒸馏。下列说法错误的是( )
- A、 反应时采用水浴加热
- B、 分液使用到的玻璃仪器有分液漏斗和烧杯
- C、 纯碱洗的主要目的是除去未反应的酸
- D、 蒸馏时硝基苯先从混合物中气化分离
绿原酸(C16H18O9)是一种有机弱酸,金银花的水浸取液经下列操作可获得绿原酸粗品。
 下列说法错误的是( )
下列说法错误的是( )
- A、 加盐酸是为了提高绿原酸的萃取率
- B、 分液时应先打开分液漏斗顶塞,再打开旋塞,使水层从分液漏斗下口放出
- C、 减压蒸馏的目的是降低蒸馏温度,有利于绿原酸挥发
- D、 该流程中可循环利用的物质是乙酸乙酯
下列图示的实验或操作正确的是( )
| A | B | C | D |
| | | | |
| 分离甲苯和水 | 浓硫酸的稀释 | 除去CO中的CO2 | 萃取振荡时放气 |
- A、 A
- B、 B
- C、 C
- D、 D
除去下列各组物质中的少量杂质,所选用的试剂及操作方法均合理的是(括号内的物质为杂质,所选试剂均足量)( )
| 选项 | 物质 | 试剂 | 操作方法 |
| A | | 蒸馏水 | 过滤 |
| B | | | 萃取、分液 |
| C | 乙烷(乙烯) | 酸性 | 洗气、干燥 |
| D | | — | 蒸馏 |
- A、 A
- B、 B
- C、 C
- D、 D
实验是化学研究的基础,下列关于各实验装置图(部分夹持装置省略)的叙述错误的是( )

- A、 利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃)
- B、 利用装置②及相关实验现象可推知酸性:
- C、 利用装置③,由b口进气可收集
、
- D、 利用装置④可制备二氧化硫气体
利用如图装置(夹持装置略)进行实验,不能达到实验目的的是( )
- A、
 实验室制氨气
实验室制氨气 - B、
 海水蒸馏制淡水
海水蒸馏制淡水 - C、
 用乙醇萃取碘水中的I2
用乙醇萃取碘水中的I2 - D、
 用硫酸铜溶液净化乙炔气体
用硫酸铜溶液净化乙炔气体
化学与生产、生活密切相关,下列说法错误的是( )
- A、 医疗废弃物经处理可加工成儿童玩具,实现资源综合利用
- B、 海水淡化的方法有蒸馏法、电渗析法、离子交换法等
- C、 《肘后备急方》中“青蒿一握,以水二升渍,绞取汁”描述了中药的溶解与过滤
- D、 商代制作的工艺精湛的司母戊鼎主要成分是铜、锡、铅
实验室分离Fe3+和Al3+的流程如图:

已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]- , 该配离子在乙醚(El2O, 沸点34.6℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )
- A、 酸化后,铁元素在溶液中主要以[FeCl4]形式存在
- B、 萃取分液时,有机层从分液漏斗上口倒出
- C、 反萃取后,铁元素在溶液中主要以Fe3+形式存在
- D、 蒸馏时,用酒精灯直接加热蒸馏烧瓶以加快蒸馏速度
下列选用的仪器和药品能达到实验目的的是( )
- A、
 检验浓硫酸与铜反应后的产物中是否含有 Cu2+
检验浓硫酸与铜反应后的产物中是否含有 Cu2+ - B、
 蒸馏时的接收装置
蒸馏时的接收装置 - C、
 制取 NaHCO3
制取 NaHCO3 - D、
 准确量取一定体积K2Cr2O7 标准溶液
准确量取一定体积K2Cr2O7 标准溶液












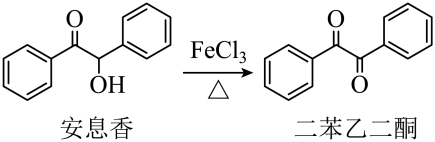

 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl

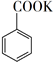
 )广泛用于皂用香精和烟草香精中,可由苯和乙酸酐制备。
)广泛用于皂用香精和烟草香精中,可由苯和乙酸酐制备。 
 +(CH3CO)2O
+(CH3CO)2O