选择题
下列有关实验说法错误的是( )
- A、 萃取
时,向盛有溴水的分液漏斗中加入
,振荡、静置分层后,打开旋塞,先将水层放出
- B、 做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色
- C、 乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞
- D、 可用
溶液和稀
区分
、
和
实验室分离Fe3+和Al3+的流程如下:

知Fe3+在浓盐酸中生成黄色配离子(FeCl4),该配离子在乙醚(Et2O,沸点34.6℃)中生成缔合物 。下列说法错误的是( )
- A、 萃取振荡时,分液漏斗下口应倾斜向下
- B、 分液时,应先将下层液体由分液漏斗下口放出
- C、 分液后水相为无色,说明已达到分离目的
- D、 蒸馏时选用直形冷凝管
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是( )
- A、 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
- B、 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
- C、 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
- D、 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
化学与生活、科技密切相关。下列叙述正确的是( )
- A、 根据垃圾分类标准,医用一次性注射器与废纸盒、空易拉罐 、矿泉水瓶都属于可回收垃圾
- B、 古法酿酒工艺中有多种酶参与催化反应
- C、 锂电池相比锂离子电池具有更高的比能量和安全性,其成果荣获2019年度诺贝尔化学奖
- D、 《本草纲目》中“黄连”条目下记载:“吐血不止,用黄连一两,捣碎,加鼓二十粒,水煎去渣。温服。”该过程中涉及实验操作包括称量、加热、萃取、分液。
从海带中提取碘的实验中,包括灼烧、浸取和过滤、氧化、萃取、反萃取等步骤。下列说法正确的是( )
- A、 灼烧中用到的仪器有蒸发皿、三脚架、酒精灯、玻璃棒
- B、 过滤中用到的仪器只有烧杯、漏斗(带滤纸)、铁架台
- C、 萃取得到碘的四氯化碳溶液,分液时从分液漏斗上口倒出
- D、 反萃取是在有机相中加入浓氢氧化钠溶液,振荡、静置、分液,再向水相中滴加45%硫酸溶液,过滤得固态碘
利用下列实验装置能达到实验目的的是( )
- A、
 分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液 - B、
 验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应 - C、
 蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体 - D、
 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱
将两种互不相溶的液体分离的方法是( )
- A、 纸层析
- B、 结晶
- C、 分液
- D、 过滤
实验室从干海带中提取碘的操作过程中,仪器选用错误的是( )
- A、 灼烧干海带﹣﹣坩埚
- B、 过滤海带灰悬浊液﹣﹣长颈漏斗
- C、 从碘水中萃取碘﹣﹣分液漏斗
- D、 分离碘和四氯化碳﹣﹣蒸馏烧瓶
下列有关实验中的基本操作正确的是( )
- A、 胶头滴管插入滴瓶后,要再挤一下胶头使溶液进入滴管中
- B、 插入橡皮导管的玻璃导管一端蘸水,然后再边旋转边插入
- C、 容量瓶内装水,塞上塞子倒转不漏水即说明该容量瓶可用
- D、 分液漏斗中下层液体放出后,换一个接液烧杯放上层液体
由物理变化引起的颜色改变是()
- A、 光照使
 和
和  的混合气体变浅
的混合气体变浅 - B、 浓硫酸使蔗糖变黑
- C、 溴水中加苯振荡使水层褪色
- D、 通电使
 溶液变浅
溶液变浅
海水是重要的水资源,下列方法可用于淡化海水的是( )
- A、 蒸馏法
- B、 过滤法
- C、 分液法
- D、 萃取法
《本草纲目》中收载“烧酒”篇:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”《本草经集注》中记载有关于鉴别消石(KNO3)和朴消(Na2SO4)之法:以火烧之,紫青烟起,云是真消石也”。文字中两处渉及到“法”。分别是( )
- A、 蒸馏 焰色反应
- B、 萃取 升华
- C、 蒸馏 丁达尔效应
- D、 升华 焰色反应
化学与生产生活密切相关。下列有关说法正确的是( )
- A、 用菜籽油浸泡辣椒涉及萃取知识
- B、 玻璃容器可以长期盛放各种酸
- C、 用氨做制冷剂是因为氨极易溶于水
- D、 不锈钢的防腐原理与电化学有关
《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是( )
- A、 “薪柴之灰”可与铵态氮肥混合施用
- B、 “以灰淋汁”的操作是萃取
- C、 “取碱”得到的是一种碱溶液
- D、 “浣衣”过程有化学变化
《本草纲目》中“黄连”条目下记载:“吐血不止,用黄连一两,捣碎,加鼓二十粒,水煎去渣,温服。”该过程中没有涉及的操作是( )
- A、 分液
- B、 加热
- C、 称量
- D、 过滤
下列对文献记载内容理解错误的是( )
- A、 《天工开物》记载“凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测”,“相激火生”是指爆炸
- B、 《本草经集注》记载鉴别硝石(KNO3)和朴硝(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,该方法是升华
- C、 《本草纲目》“烧酒”写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这种方法是蒸馏
- D、 东晋葛洪《肘后备急方》中称“青蒿一握,以水二升渍,绞取汁”,屠呦呦以此法提取青蒿素属于萃取
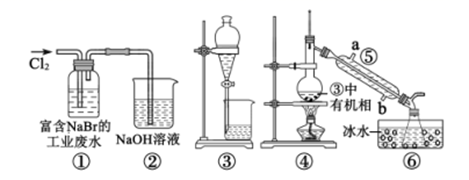
从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法错误的是( )
- A、 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
- B、 甲装置中NaOH溶液每吸收0.1mol Cl2 , 转移0.1mol e—
- C、 用乙装置进行萃取,溶解Br2的有机层在下层
- D、 用丙装置进行蒸馏,先收集到的是Br2






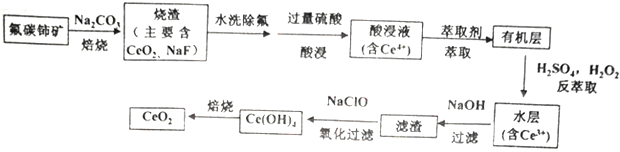

 )是一种常用镇痛药,难溶于水,易溶于醇、醚类。实验室里可由对氨基苯甲酸(
)是一种常用镇痛药,难溶于水,易溶于醇、醚类。实验室里可由对氨基苯甲酸( )与乙醇反应合成。
)与乙醇反应合成。 