选择题
| 选项 | 目的 | 实验 |
| A | 制取较高浓度的次氯酸溶液 | 将Cl2通入碳酸钠溶液中 |
| B | 加快氧气的生成速率 | 在过氧化氢溶液中加入少量MnO2 |
| C | 除去乙酸乙酯中的少量乙酸 | 加入饱和碳酸钠溶液洗涤、分液 |
| D | 制备少量二氧化硫气体 | 向饱和亚硫酸钠溶液中滴加浓硫酸 |
- A、 A
- B、 B
- C、 C
- D、 D

- A、 A
- B、 B
- C、 C
- D、 D
- A、 通过浓硫酸除去HCl中的H2O
- B、 通过灼热的CuO除去H2中的CO
- C、 通过灼热的镁粉除去N2中的O2
- D、 通过水除去CO中的CO2
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( ) 
- A、 操作Ⅰ是过滤,将固体分离除去
- B、 操作Ⅱ是加热浓缩.趁热过滤,除去杂质氯化钠
- C、 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来
- D、 操作Ⅰ~Ⅲ总共需两次过滤
选项 | A | B | C | D |
操作或 装置 |
|
|
|
|
实验目的 | 除去Cl2中混有的HCl | 测定中和热 | 制取碳酸氢钠 | 中和滴定 |
- A、 A
- B、 B
- C、 C
- D、 D
| 选项 | 物质 | 除杂试剂 | 除杂方法 |
| A | | 饱和 | 洗气 |
| B | 乙酸乙酯(乙酸) | 乙醇、浓硫酸 | 分液 |
| C | | 通过灼热的C | 洗气 |
| D | | 过量的 | 过滤 |
- A、 A
- B、 B
- C、 C
- D、 D
方法Ⅰ NaClO + 2HCl(浓) = NaCl + Cl2↑ + H2O;
方法Ⅱ 4HCl(g) + O2(g) = 2H2O(g) + 2Cl2(g) ΔH = a kJ·mol−1
上述两种方法涉及的反应在一定条件下均能自发进行。利用方法Ⅰ制备Cl2时,下列装置能达到实验目的的是( )

- A、 图甲:制备Cl2
- B、 图乙:除去Cl2中的少量HCl
- C、 图丙:干燥Cl2
- D、 图丁收集Cl2
| 选项 | 实验目的 | 实验操作 |
| A | 除去 | 将混合气体通过饱和 |
| B | 配制 | 将 |
| C | 比较 | 同温下,用 |
| D | 除去 | 将固体溶于水配成溶液,蒸发浓缩、冷却结晶 |
- A、 A
- B、 B
- C、 C
- D、 D
- A、 二氧化氯泡腾片和75%酒精均可杀灭新型冠状病毒,二者消毒时均表现为强氧化性
- B、 台积电断供华为5G手机麒麟9000芯片(HUAWEIKirin),此芯片主要成分是二氧化硅
- C、 热的纯碱溶液可用于除去金属表面的矿物油(如机油、润滑油等)
- D、 亚硝酸钠易致癌,但火腿肠中可加入少量的亚硝酸钠以保持肉质新鲜

下列说法错误的是( )
- A、 ZnFe2O4溶于硫酸的离子方程式:ZnFe2O4+8H+=Zn2++2Fe3++4H2O
- B、 加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+
- C、 加过量ZnS可除去溶液中的Cu2+是利用了Ksp(ZnS)>Ksp(CuS)
- D、 为加快反应速率,净化I和净化II均应在较高的温度下进行

- A、 海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等
- B、 在氯碱工业中,电解饱和食盐水可得到氢气、氯气和烧碱
- C、 在制镁工业中,由步骤②得到镁的反应中,另一产物可用于步骤③⑤中作氧化剂
- D、 在制溴工业中,步骤③④⑤分别为浓缩、氧化、提取

- A、 饱和食盐水的作用是除去氯气中的HCl
- B、 NaOH溶液不可以用水代替
- C、 由反应H2O2+Cl2=2HCl+O2可证明非金属性:Cl>O
- D、 仅根据此实验现象无法证明一定是氯气氧化了H2O2
| 选项 | 实验目的 | 药品 | 主要玻璃仪器 |
| A | 除去KI晶体中混有的I2 | 烧杯、圆底烧瓶、酒精灯 | |
| B | 除去SO2中混有的HCl | 饱和Na2SO3溶液 | 洗气瓶 |
| C | 除去BaSO4中混有的BaCl2 | 水 | 漏斗、玻璃棒、烧杯 |
| D | 除去乙酸乙酯中混有的乙酸 | 饱和Na2CO3溶液 | 分液漏斗、烧杯 |
- A、 A
- B、 B
- C、 C
- D、 D
| A | B | C | D |
| | | | |
| 向容量瓶中转移液体 | 实验室制备氨气 | 除去甲烷中混有的少量乙烯 | 氯气的净化 |
- A、 A
- B、 B
- C、 C
- D、 D
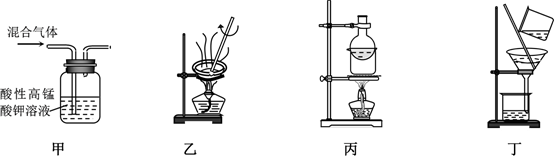
- A、 用装置甲除去乙烯中的少量SO2
- B、 用装置乙除去碳酸氢钠中的少量碳酸钠
- C、 用装置丙除去固体碘中的少量NH4Cl
- D、 用装置丁除去二氧化锰中的少量氯酸钾

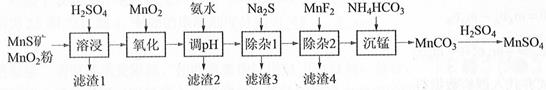
下列说法正确的是( )
- A、 用少量氨水吸收“焙烧”产生的气体,所得溶液可用于“沉锰”
- B、 “焙烧”过程在高压、密闭容器进行转化率更高
- C、 “沉锰”的主要反应为
- D、 工艺中的硫酸表现酸性和氧化性

- A、 装置①中反应的氧化剂与还原剂的物质的量之比为1:5
- B、 装置②的作用是除去氯气中的HCl,同时可监测装置③中是否发生堵塞
- C、 装置③与装置⑤的作用完全相同
- D、 三氯化碘溶于水中发生反应的化学方程式为ICl3+2H2O=HIO3+3HCl
- A、 中和反应反应热的测定,需要准确读取酸碱溶液混合后的最高温度
- B、 将4.0g NaOH置于100mL容量瓶中,加水配制1.000mo/LNaOH溶液
- C、 除去甲烷中的乙烯,可以依次通过酸性KMnO4溶液、NaOH溶液、浓H2SO4
- D、 探究Fe2+能转化为Fe3+ , 可以向FeCl2溶液中依次滴加KSCN溶液、氯水
| | | | |
| I | II | III | IV |
- A、 装置Ⅰ可用于Zn粒与稀H2SO4反应制H2
- B、 装置Ⅱ可用于除去CO2气体中的SO2
- C、 装置Ⅲ可用于收集NO2
- D、 装置Ⅳ可用于验证氧化性Cl2>I2
- A、 溴苯(Br2)—— 分液
- B、 乙酸丁酯(正丁醇 )—— 过滤
- C、 乙酸乙酯(乙酸)—— 蒸馏
- D、 氯化铵(I2)—— 加热
- A、 除去CO中混有的少量CO2:通过硝酸钡溶液
- B、 除去CH4中混有的少量乙烯:通过酸性高锰酸钾溶液
- C、 除去CaCl2溶液中混有的少量盐酸:加入过量的碳酸钙、过滤
- D、 除去NaCl溶液中的少量杂质Na2CO3:加入过量的氯化钡溶液、过滤
- A、 Al2O3(Fe2O3):盐酸,过滤
- B、 硝基苯(苯):蒸馏
- C、 己烷(己烯):加溴水,分液
- D、 CO2(SO2):饱和Na2CO3溶液,洗气

其中除杂过程包括:①室温下,向滤液中加入一定量的试剂X,调节滤液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水( ),过滤。已知:室温下,
。下列说法正确的是( )
- A、 “浸出”时没有发生氧化还原反应
- B、 “除杂”试剂X可以是MnO
- C、 室温下,“除杂”时调节滤液的pH为4,此时
- D、 “沉淀”时加入过量的
溶液,发生反应的离子方程式为
| A | B | C | D |
| | | | |
| 除去 | 相同温度下的溶解度: | 检验溴乙烷水解产物中含有 | 检验 |
- A、 A
- B、 B
- C、 C
- D、 D
- A、 用
溶液除去乙炔中的
- B、 用酸性
溶液除去
中的
- C、 用焰色试验鉴别
溶液和
溶液
- D、 用盐酸鉴别
固体和
固体
- A、 HCl
- B、 CH3COOH
- C、 NaOH
- D、 NH3·H2O

- A、 ①
- B、 ②
- C、 ③
- D、 ④
| 选项 | 实验目的 | 实验操作 |
| A | 除去 | 先后通过盛有酸性 |
| B | 除去 | 加入过量 |
| C | 检验溶液中含有 | 加入 |
| D | 检验稀硫酸催化淀粉水解的产物为葡萄糖 | 向水解后的溶液中直接加入新制 |
- A、 A
- B、 B
- C、 C
- D、 D
- A、 FeSO4常用于制取净水剂,原因是溶于水时形成具有净水作用的氢氧化亚铁胶体
- B、 纳米铁粉和FeS都可以去除水体中的Cu2+、Hg2+等离子,其原理不相同
- C、 SO2具有还原性,可用KMnO4溶液测定食品中SO2残留量
- D、 利用碳酸钠溶液可消除燃煤烟气中的SO2