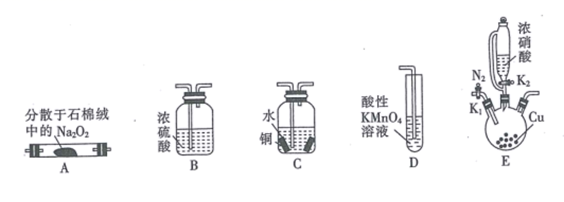
选择题
常温下,用  氨水滴定
氨水滴定  浓度均为
浓度均为  的
的  和
和  的混合液,下列说法错误的是( )
的混合液,下列说法错误的是( )
- A、 在氨水滴定前,
和
的混合液中
- B、 当滴入氨水
时,
- C、 当滴入氨水
时,
- D、 当溶液呈中性时,氨水滴入量大于
,
以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数  随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:
随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:  ]
]

下列叙述正确的是( )
- A、 曲线①代表
,曲线②代表
- B、 H2A溶液的浓度为0.2000 mol·L−1
- C、 HA−的电离常数Ka=1.0×10−2
- D、 滴定终点时,溶液中
25℃时,下列说法正确的是( )
- A、 H2A溶液与NaOH溶液按物质的量1:1恰好完全反应时,溶液酸碱性无法判断
- B、 可溶性正盐BA溶液呈中性,可以推测BA对水的电离没有影响
- C、 醋酸的电离度:pH=3的醋酸溶液大于pH=4的醋酸溶液
- D、 pH=2的HCl和pH=12的Ba(OH)2溶液等体积混合后,溶液显碱性
常温下,将HCl气体通入0.1 mol/L氨水中,混合溶液中pH与微粒浓度的对数值(lgc)和反应物物质的量之比X[X=  ]的关系如图所示(忽略溶液体积的变化),下列说法正确的是( )
]的关系如图所示(忽略溶液体积的变化),下列说法正确的是( )

- A、 NH3·H2O的电离平衡常数为10-9.25
- B、 P2点由水电离出的c(H+)=1.0×10-7 mol/L
- C、 P3为恰好完全反应点,c(Cl-)+c(NH
)=0.2 mol/L
- D、 P3之后,水的电离程度一直减小
根据各图曲线表征的信息,得出的结论错误的是( )

- A、 图1表示常温下向体积为10 mL.0.1 mol/L的NaOH 溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则c点处有:c(CH3COOH)+2c(H+)=2c(OH-)+c(CH3COO-)
- B、 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a
- C、 图3中在b点对应温度下,将pH=2的H2SO4 , 与pH=10的NaOH溶液等体积混合后,溶液显中性
- D、 由图4曲线,可确定K(AgCl)>K(AgBr)>K(AgI),故用0.0100 mol/L.硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl- , Br-及I-的混合溶液时,首先沉淀的是I-
常温下,用  的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:
的盐酸滴定20mL相同浓度的某一元碱BOH溶液,滴定过程中pH及电导率变化曲线如图所示:

下列说法正确的是( )
- A、 BOH的Kb约为1×10-3
- B、 a点的c(B+)大于b点
- C、 a点溶液中:c(B+)+c(H+)=2c(OH-)+c(BOH)
- D、 滴定至pH=7时,c(B+)=c(Cl-)<0.1mol•L-1
常温下用0.2mol·L-1NaOH溶液分别滴定0.2mol·L-1一元酸HA和HB,混合溶液的pH与离子浓度变化的关系如图所示。下列有关叙述错误的是( )
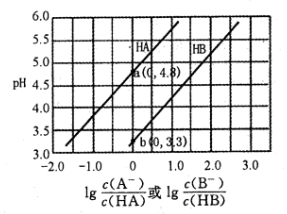
- A、Ka(HA)的数量级为10-5
- B、 酸碱恰好反应时,HB溶液中的pH为9.15
- C、 反应HA+B-=HB+A-的平衡常数为10-1.5
- D、 相同条件下对水的电离影响程度:NaA>NaB
用0.1000 mol·L-1 NaOH溶液分别滴定20 mL 0.1000 mol·L-1 HCl和HAc(醋酸)的滴定曲线如图。下列说法正确的是( )
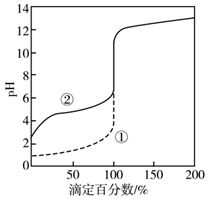
- A、 0.1000 mol·L-1 HAc的电离百分数约为10%
- B、 两个滴定过程均可用甲基橙做指示剂
- C、 滴定百分数为50%时,曲线②溶液中c(Ac-)>c(Na+)
- D、 图像的变化证实了Ac-的碱性很强
常温下,用0.1mol·L-1NaOH溶液滴定0.10 mol·L-1HA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列陈述错误的是( )

- A、 Ka(HA)的数量级为10-5
- B、 N点,c(Na+)-c(A-)=
- C、 P到Q过程中,水的电离程度逐渐增大
- D、 当滴定至溶液呈中性时,c(A-)>c(HA)
实验室完成下列操作,一般不宜使用锥形瓶的是( )
- A、 实验室制蒸馏水
- B、 酸碱中和滴定
- C、 配制一定浓度的H2SO4溶液
- D、 用高锰酸钾与浓盐酸制Cl2
某温度下,将0.1mol·L-1一元弱碱(BOH)溶液滴入10mL0.1 mol·L-1一元酸(HA)溶液中,混合溶液 pH 和温度随加入碱溶液体积变化曲线如图所示。下列有关说法错误的是( )

- A、 曲线M是温度变化曲线,曲线N是PH变化曲线
- B、 水的电离程度:b>c>a>d
- C、 c 点存在守恒关系:c(B+)=c(A-)
- D、 b点:c(A-)>c(B+)>c(H+)>c(OH-)
保持温度始终为T℃,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速率来滴定,根据测定结果绘制出ClO-、ClO  的物质的量浓度c与时间t的关系曲线(如图)。下列说法正确的是( )
的物质的量浓度c与时间t的关系曲线(如图)。下列说法正确的是( )

- A、 0~t1时发生反应的离子方程式:OH-+Cl2=Cl-+ClO-+H2O
- B、 a点溶液中:c(ClO-)>c(ClO
)>c(Na+)>c(OH-)>c(H+)
- C、 b点溶液中:c(Na+)+c(H+)=8c(ClO-)+c(OH-)
- D、 t2~t4过程中:
一直减小
常温下,某H3AsO4溶液中逐滴加入NaOH,溶液中含砷微粒的分布分数(某含砷微粒的物质的量浓度占所有含砷微粒物质的量浓度之和的分数)与pH的变化关系如下图所示。下列说法正确的是( )
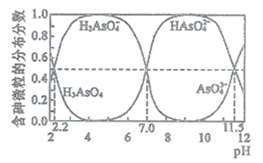
- A、 H3AsO4的第一步电离常数Ka1>0.01
- B、 pH=11.5时,c(H2AsO
)+2c(HAsO
)+3c(AsO
)+c(OH-)=c(H+)
- C、 Na3AsO4溶液中,3c(Na+)=c(AsO
)+ c(HAsO
)+c(H2AsO
)+c(H3AsO4)
- D、 以酚酞为指示剂,将 NaOH 溶液逐滴加入到H3AsO4溶液中,当溶液由无色变为浅红色时停止滴加。该反应的离子方程式为2OH-+H3AsO4= HAsO
+2H2O
25℃时,向20 mL 0.10 mol·L-1一元酸HA中逐滴加入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是( )
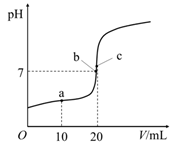
- A、 HA是强酸
- B、 a点,c(Na+) =c(A-) +c(HA)
- C、 b点为滴定终点,c(Na+) >c(A-)
- D、 c点,水的电离程度最大
25℃时,用  溶液滴定某二元弱酸
溶液滴定某二元弱酸  ,
,  被滴定分数
被滴定分数  、pH及微粒分布分数
、pH及微粒分布分数  [
[  ,X表示
,X表示  、
、  或
或  ]的关系如图所示:
]的关系如图所示:

下列说法错误的是( )
- A、
点溶液中溶质为
和
- B、
点溶液中:
- C、
点溶液中:
- D、 a、b、c、d四点溶液中水的电离程度:
室温下,在25 mL某浓度的NaOH溶液中,逐滴加入0.1 mol·L-1醋酸,滴定曲线如图所示。则下列说法正确的是( )

- A、 从A点到B点的过程中,溶液的导电能力几乎不变
- B、 a点对应的体积值等于25 mL
- C、 C点时,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
- D、 D点时,c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
25℃,已知二元弱酸H3PO3的lgKa1=-1.3,1gKa2=-6.6,用0.1mol·L-1 NaOH溶液滴定20mL 0.1mol·L-1 H3PO3溶液的滴定曲线如图所示,下列说法错误的是( )

- A、 加入NaOH溶液之前,溶液的pH约为1.2
- B、 c点,c (H2PO
)>c(HPO
)
- C、 b,c,d三点的溶液中,d点水电离出来的c(H+)最大
- D、 若取b点溶液与0.1mol/L的氨水溶液等体积混合(体积变化可忽略)c(NH3·H2O)<c(H2PO
)+2c(H3PO3)+0.025mol·L-1
25℃时,用1.00 mol·L-1 NaOH溶液调节100 mL某二元弱酸H2A的pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示。下列说法正确的是( )

- A、 曲线②代表c(HA-),曲线③代表c(A2-),H2A的Ka2=10-8
- B、 x点溶液中,n(Na+)=n(H2A)+n(HA-)+n(A2-)
- C、 在Y点溶液中,c(Na+)>3c(A2-)
- D、 0.1000 mol·L-1 NaHA溶液中,c(Na+)>c(HA-)>c(H2A)>c(A2-)
次磷酸(H3PO2)是一种精细磷化工产品。常温下,某实验小组以酚酞为指示剂,用0.100 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的次磷酸(H3PO2)溶液。溶液pH、所有含磷微粒的分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。[比如H2PO  的分布系数:δ(H2PO
的分布系数:δ(H2PO  )=
)=  ],下列叙述正确的是( )
],下列叙述正确的是( )

- A、 曲线①代表δ(H2PO
),曲线②代表δ(HPO
)
- B、 H3PO2溶液的浓度为0.100 mol·L-1
- C、 H2PO
水解常数Kh≈1.0×10-10
- D、 NaH2PO2是酸式盐,其水溶液显碱性
电位滴定法是根据滴定过程中指示电极电位的变化来确定滴定终点的一种滴定分析方法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位(ERC)也产生了突跃,进而确定滴定终点的位置。现利用盐酸滴定某溶液中碳酸钠含量,其电位滴定曲线如图所示。下列说法错误的是( )

- A、 该滴定过程中不需任何指示剂
- B、 a点溶液中存在:c(Na+)>c(HCO
)+c(CO
)+c(H2CO3)
- C、 b点溶液呈酸性
- D、 a到b之间存在:c(Na+)<c(Cl-)
常温下,用0.10mol·L-1NaOH溶液滴定10mL0.10mol·L-1H2A溶液,测得滴定曲线如下。下列说法正确的是( )

- A、 溶液①中H2A的电离方程式是H2A
2H++A2-
- B、 溶液②中c(HA-)>c(A2-)>c(HA-)
- C、 溶液③中c(Na+)=c(HA-)+c(A2-)
- D、 溶液④中c(Na+)=c(A2-)+c(HA-)+c(H2A)
根据下列图示所得出的结论错误的是( )
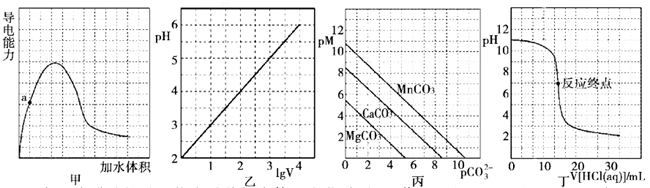
- A、 图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的
试纸测量a点的
,则测量结果可能偏小
- B、 图乙表示
的盐酸溶液加水稀释至
随
的变化关系图
- C、 图丙表示一定温度下三种碳酸盐
的沉淀溶解平衡曲线图
,则有
、
、
的
依次减小
- D、 图丁表示
盐酸滴定
溶液的滴定曲线
常温下,  ,分别向
,分别向  溶液和
溶液和  溶液中逐滴加入
溶液中逐滴加入  溶液,滴定曲线如右图所示,下列叙述正确的是( )
溶液,滴定曲线如右图所示,下列叙述正确的是( )

- A、 a点溶液中存在:
- B、 a、b点溶液中钠离子浓度的关系为:
- C、 c点溶液中存在:
- D、 d点溶液中:
已知:在室温下有以下平衡:
| 编号 | 平衡方程式 | 平衡常数 |
| ① | HCN | Ka= 1×10 -10 |
| ② | H2O | Kw=1×10 -14 |
| ③ | CN-+H2O | K =? |
则下列判断错误的是( )
- A、 ①的ΔS>0, ΔH>0
- B、 用标准 NaOH 溶液滴定浓度约为 0.01mol•L-1HCN,可用甲基橙做指示剂
- C、 0. 2mol•L-1 的 HCN 溶液中加入等体积的 0.1mol•L-1NaOH 溶液,则该溶液呈碱性
- D、 0. 2mol•L-1 的HCN 溶液中加入等体积的 0.1mol•L-1NaOH 所得的混合溶液中: 2c(H+)+c(HCN) = 2c(OH-)+c(CN- )
根据下列图示所得出的结论错误的是( )

- A、 图甲是常温下用 0.1000 mol·L-1 NaOH 溶液滴定 20.00mL 0.1000 mol·L-1 CH3COOH 的滴定曲线,说明 Q 点表示酸碱中和滴定终点
- B、 图乙是 1mol X2(g)、1mol Y2(g)反应生成 2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
- C、 图丙是恒温密闭容器中发生CaCO3(s)⇌ CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
- D、 图丁是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照 氯水有O2生成
常温下,用0.010mol/L的NaOH溶液滴定10.00mL 0.010mol/L的酸H2A,滴定过程中加入NaOH溶液的体积(V)与溶液中lg  的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )
的关系如图所示(10mL之后的曲线未画出)。下列叙述正确的是( )

- A、 H2A
H++HA-
- B、 Ka(HA-)的数量级为10-5
- C、 滴定过程中,水的电离程度最大的为B点溶液
- D、 V(NaOH)=15mL时的溶液中:c(Na+)>c(A2-)>c(HA-)