选择题
室温下,用0.100mol•L﹣1 NaOH溶液分别滴定20.00mL 0.100mol•L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
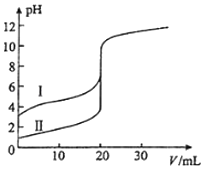
- A、 Ⅱ表示的是滴定醋酸的曲线
- B、 pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
- C、 V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
- D、 V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
NaOH溶液滴定盐酸实验中,不必用到的是( )
- A、 酚酞
- B、 圆底烧杯
- C、 锥形瓶
- D、 碱式滴定管
下列图示与对应的叙述不相符合的是( ) 
- A、 图甲表示燃料燃烧反应的能量变化
- B、 图乙表示酶催化反应的反应速率随反应温度的变化
- C、 图丙表示弱电解质在水中建立电离平衡的过程
- D、 图丁表示强碱滴定强酸的滴定曲线
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L﹣1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( ) 
- A、 三种酸的电离常数关系:KHA>KHB>KHD
- B、 滴定至P点时,溶液中:c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣)
- C、 pH=7时,三种溶液中:c(A﹣)=c(B﹣)=c(D﹣)
- D、 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH﹣)﹣c(H+)
常温下,在体积均为20mL、浓度均为0.1mol•L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)的负对数[-lgc(H+)水]与滴加氢氧化钠溶液体积的关系如图所示:下列说法错误的是( )

- A、 a、b、c三点溶液均显中性
- B、 a点溶液,c(Na+)=c(X-)>c(H+)=c(OH-)
- C、 b点溶液中的离子总浓度大于d点溶液
- D、 常温下,Ka(HX)≈10-5
25℃先将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的KOH溶液以测定氯水的浓度。此过程中溶液pH变化的曲线如图所示。
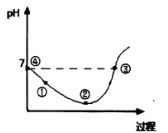
下列叙述中正确的是( )
- A、 滴定过程中,当水电离的c(H+)=10-7mol/L时,溶液显中性
- B、 滴定过程中宜选用酚酞为指示剂,不宜选用甲基橙为指示剂
- C、 ②点的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-)
- D、 ③点溶液中c(K+)+c(H+)=c(OH-)+c(Cl-)
室温下,用相同浓度的NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的三种酸(HA、HB和HC)溶液,滴定的曲线如图所示,下列判断错误的是( )

- A、 当中和百分数达50%时:
- B、 滴定至①点时,溶液中:
- C、 当中和百分数达100%时,消耗的NaOH溶液体积
- D、 ①和④所示溶液中都有:
有关酸碱中和滴定的说法正确的是( )
- A、 可用石蕊作指示剂
- B、 滴定时眼睛注视滴定管中液面下降
- C、 需做平行实验2~3次
- D、 当溶液颜色变化时立即读数
有关酸碱滴定实验,下列说法的正确的是( )
- A、 滴定管和锥形瓶都需要使用蒸馏水和待装液润洗
- B、 滴定前,必须将滴定管中液体的液面调至0刻度
- C、 滴定至终点时,溶液一定呈中性
- D、 测定待测液的浓度,至少需要完成两组平行实验,取消耗标准液的平均值
实验室用标准盐酸滴定氢氧化钠溶液,下列情况不影响测定结果的是( )
- A、 洗净的锥形瓶,再用碱液润洗
- B、 酸式滴定管洗净后,直接注入标准盐酸
- C、 在放碱液时,锥形瓶中留有少量蒸馏水
- D、 滴定至终点时,在滴定管尖嘴部位有气泡
下列酸碱溶液恰好完全中和,如图所示,则下列叙述正确的是( )

- A、 因为两种酸溶液的pH相等,故V1一定等于V2
- B、 若V1>V2 , 则说明HA为强酸,HB为弱酸
- C、 若实验①中,V=V1 , 则混合液中c(Na+)=c(A-)
- D、 实验②的混合溶液,可能溶液呈酸性
已知Ka(CH3COOH)=1.7×10−5 ,Kb(NH3·H2O)=1.7×10−5。常温下,用0.01mol·L−1氨水滴定20 mL浓度均为 0.01 mol·L−1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )

- A、 a点的混合溶液中c(CH3COO−)约为1.7×10−5mol·L−1
- B、 b点的混合溶液中:c(CH3COOH) >c(NH4+)
- C、 c点的混合溶液中:
- D、 混合溶液pH=7时,加入氨水体积大于40mL
常温下,用0.1mol/LKOH溶液滴定10mL0.1mol/LHA溶液的滴定曲线如图所示。下列说法错误的是( )

- A、 a点pH约为3,可以判断HA是弱酸
- B、 b点溶液:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
- C、 c点溶液:c(K+)=c(A-)
- D、 水的电离程度:c点>d点
室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
- A、 滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
- B、 pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-)
- C、 当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4)
- D、 0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
室温下,用0.1000mol•L-1NaOH溶液滴定20mL0.1000mol•L-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法错误的是( )

- A、 H3PO4的电离平衡常数Ka1约为10-2
- B、 当V(NaOH溶液)=40mL时,c(PO
)+c(OH-)=c(H+)+c(H2PO
)+2c(H3PO4)
- C、 当pH=7时,c(Na+)=c(H2PO
)+2c(HPO
)+3c(PO
)
- D、 当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO
)>c(H3PO4)>c(HPO
)
下列图示与对应的叙述正确的是( )
- A、
 反应达到平衡后,升高温度,平衡常数K值变大
反应达到平衡后,升高温度,平衡常数K值变大 - B、
 表示镁条放入盐酸中生成氢气速率随时间的变化
表示镁条放入盐酸中生成氢气速率随时间的变化 - C、
 表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化
表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化 - D、
 表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化
25℃下,向20mL0.1mol•L-1HA溶液中逐滴加入0.1mol•L-1NaOH溶液,随滴入NaOH溶液体积的变化混合溶液的pH的变化如图所示。下列说法正确的是( )

- A、 A-的水解常数约为10-11
- B、 水的电离程度:e>d>c>b>a
- C、 c点和d点溶液中均符合c(Na+)=c(A-)
- D、 b点溶液中粒子浓度关系:c(A-)>c(HA)>c(H+)>c(OH-)
已知:pKa=- lgKa, 25℃时,弱酸H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mo/L NaOH溶液滴定20 mL 0.1 mol/L H2A溶液的曲线如下图所示。

下列说法错误的是( )
- A、 d点所得溶液中溶质的水解平衡常数Kh1=10-7.19
- B、 c点所得溶液中:c(Na+)+c(H+)= 2c(A2-)+c(HA-)+c(OH-)
- C、 b点所得溶液中:c(A2-)>c(H2A)
- D、 a点所得溶液中:溶质是NaHA和H2A
室温时,向20.0 mL 0.10 mol·L-1的两种酸HA、HB中分别滴加0.10 mol·L-1 NaOH溶液,其pH变化分别对应图中的Ⅰ、Ⅱ。下列说法错误的是( )

- A、 向NaA溶液中滴加HB可产生HA
- B、 a点时,溶液中存在:c(A-)>c(Na+)>c(HA)
- C、 滴加NaOH溶液至pH=7时,两种溶液中c(A-)=c(B-)
- D、 滴加20.0 mL NaOH溶液时,水的电离程度:Ⅰ>Ⅱ
常温下,向20mL0.05mol•L-1的某稀酸H2B溶液中滴入0.1mol•L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确是( )

- A、 NaHB溶液中一定含有H2B分子
- B、 A,B,C三点溶液的pH逐渐减小,D、E、F三点溶液的pH逐渐增大
- C、 E溶液中离子浓度大小关系为c(NH4+)>c(B2-)>c(H+)>c(OH-)
- D、 B点溶液pH=7
已知某二元酸H2MO4在水中电离分以下两步:H2MO4⇌H++HMO4- , HMO4-⇌H++MO42-。常温下向20 mL0.1mol/L NaHMO4溶液中滴入cmol/LNaOH溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确是( )

- A、 该氢氧化钠溶液pH=12
- B、 图像中F点对应的溶液中c(OH-)>c(HMO4-)
- C、 滴入NaOH溶液过程中水的电离程度一直增大
- D、 图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
常温下,向20mL0.1mol• L-1HB溶液中逐滴滴入 0.1mol• L-1NaOH溶液,所得 PH变化曲线如图所示。下列说法不正确的是 ( )

- A、 OA各点溶液均存在:c(B-) >c(Na+)
- B、 C至 D各点溶液导电能力依次增强
- C、 点 O时,PH>1
- D、 点 C时,X约为 10.4
在25mL0.1mol•L﹣1某一元碱中,逐滴加入0.1个mol•L﹣1醋酸,滴定曲线如图所示。则下列说法不正确的是( )

- A、 该碱溶液可以溶解Al(OH)3
- B、 a点对应的体积值大于25mL
- C、 C点时,c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
- D、 D点时,c(CH3COO﹣)+c(OH﹣)=c(H+)+c(CH3COOH)
已知 pOH=-lgc(OH-)。向20 mL 0.1 mol·L-1 的氨水中滴加未知浓度的稀 H2SO4 , 测得混合溶液的温度、pOH随加入稀硫酸体积的变化如下图所示,下列说法不正确的是( )
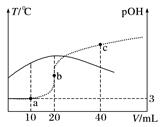
- A、 稀H2SO4 的物质的量浓度为0.05 mol·L-1
- B、 当溶液中pH=pOH时,水的电离程度最大
- C、 a点时溶液中存在c(NH3·H2O)+2c(OH-)=c(NH
)+2c(H+)
- D、 a、b、c 三点对应 NH
的水解平衡常数:Kh(b)>Kh(a)>Kh(c)
用一定浓度 NaOH 溶液滴定某醋酸溶液。滴定终点附近溶液 pH 和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。下列说法不正确的是( )
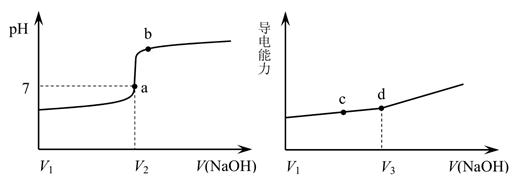
- A、 a 点对应的溶液中:c(CH3COO-) =c(Na+)
- B、 a→b 过程中,n(CH3COO-)不断增大
- C、 c→d 溶液导电性增强的主要原因是c(OH-)和c(Na+)增大
- D、 根据溶液 pH 和导电能力的变化可判断:V2<V3




