选择题
下列操作规范且能达到实验目的的是( )
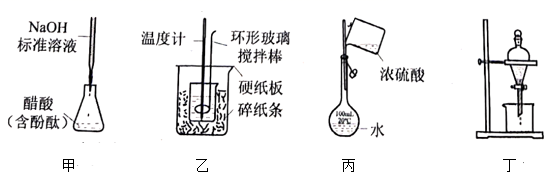
- A、 图甲测定醋酸浓度
- B、 图乙测定中和热
- C、 图丙稀释浓硫酸
- D、 图丁萃取分离碘水中的碘
下列说法不正确的是( )
- A、 手机上用的锂离子电池属于二次电池
- B、 测定中和反应的反应热,需要记录体系达到的最终温度
- C、 催化剂能加快化学反应速率是因为降低了反应的活化能,增大了活化分子百分率
- D、 温度对化学平衡的影响是通过改变平衡常数实现的
下列有关实验错误的是( )
- A、 中和反应反应热的测定,需要准确读取酸碱溶液混合后的最高温度
- B、 将4.0g NaOH置于100mL容量瓶中,加水配制1.000mo/LNaOH溶液
- C、 除去甲烷中的乙烯,可以依次通过酸性KMnO4溶液、NaOH溶液、浓H2SO4
- D、 探究Fe2+能转化为Fe3+ , 可以向FeCl2溶液中依次滴加KSCN溶液、氯水
下列实验装置或操作设计正确,且能达到实验目的是( )

- A、 实验①制备并收集少量氨气
- B、 实验②推断S、C、Si的非金属性强弱
- C、 实验③配制一定物质的量浓度溶液
- D、 实验④进行中和反应反应热的测定
下列实验能达到实验目的的是( )
| 选项 | A | B | C | D |
| 实验 | | | | |
| 实验目的 | 证明非金属性 | 分离溴苯 | 测定中和热 | 证明 |
- A、 A
- B、 B
- C、 C
- D、 D
下列装置能达到实验目的的是( )
- A、 熔化Na2CO3

- B、 保存液溴

- C、 分液,先放出水层,再倒出溴的苯溶液

- D、 进行中和热的测定

下列装置或操作能达到实验目的的是( )

- A、 用图1装置测定中和热
- B、 用图2装置制取溴苯并验证该反应类型为取代反应
- C、 用图3装置溶解并配制500mL0.1mol·L-1NaOH溶液
- D、 用图4装置验证石蜡油分解产物中含有乙烯
中和反应反应热的测定中需要用到的实验仪器有
- A、 秒表
- B、 滴定管
- C、 胶头滴管
- D、 简易量热计
下列装置使用符合题意且能达到相应实验目的的是

- A、 ①测量中和反应的反应热
- B、 ②测定
的浓度
- C、 ③探究温度对化学平衡的影响
- D、 ④测定化学反应速率
下列实验的有关说法正确的是
- A、 用pH试纸测得氯水的
- B、 用碱式滴定管量取
溶液
- C、 测定中和反应的反应热时,若用铜丝代替玻璃搅拌器,测得
偏小
- D、 中和滴定时,盛装待测液的锥形瓶如果用待测液润洗,不影响测定结果
下列操作规范(或装置正确)且能达到实验目的的是
- A、
 制取乙酸乙酯
制取乙酸乙酯 - B、
 测定中和热
测定中和热 - C、
 稀释浓硫酸
稀释浓硫酸 - D、
 测定醋酸
测定醋酸
在实验室中进行中和反应的反应热测定与中和滴定实验,一定没有用到的仪器是( )
- A、

- B、

- C、

- D、

已知:反应
 。现分别取50mL 0.50mol/L醋酸溶液与50mL 0.55mo/L NaOH溶液进行反应,用如图实验装置测定该反应的反应热
。现分别取50mL 0.50mol/L醋酸溶液与50mL 0.55mo/L NaOH溶液进行反应,用如图实验装置测定该反应的反应热 , 下列说法错误的是( )
, 下列说法错误的是( )

- A、 小烧杯和大烧杯的杯口应相平
- B、 使用环形玻璃搅拌棒是为了使反应更充分
- C、 为了让反应充分进行,NaOH分三次倒入
- D、 该实验测得的反应热
在测定中和热的实验中,下列说法正确的是( )。
- A、 使用环形玻璃搅拌棒是为了加快反应速率,减小实验误差
- B、 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
- C、 用 0.5 mol·L-1的NaOH溶液分别与 0.5 mol·L-1 的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和热数值相同
- D、 在测定中和热实验中需要使用的仪器有容量瓶、量筒、烧杯、温度计、环形玻璃搅拌棒
室温下,用50mL 0.50mol/L盐酸和50mL0.55mo/L NaOH溶液在如图所示装置中进行中和反应,并通过测定反应过程中放出的热量计算中和反应的反应热。下列说法正确的是( )

- A、 若用相同形状的细铜丝代替仪器a进行相应的实验操作,所测中和热
将偏小
- B、 HCl和NaOH反应的中和热
, 则
和
反应的中和热
- C、 该实验最少需要测定并记录温度的次数是3次
- D、 若实验测得的反应前后温度差平均值
, 中和后生成溶液的比热容
(若近似认为0.55mol/L NaOH溶液和0.50mol/L盐酸的密度都是
)。则生成1mol
(l)时的反应热
采用50mL NaOH溶液和50mL
NaOH溶液和50mL 稀盐酸进行中和反应反应热的测定实验,装置如图所示,下列说法错误的是( )
稀盐酸进行中和反应反应热的测定实验,装置如图所示,下列说法错误的是( )

- A、 仪器M的名称为玻璃搅拌器
- B、 碎泡沫塑料能减少热量的散失
- C、 加入试剂时,应缓慢加入,防止液体飞溅
- D、 可用50mL
稀硫酸代替稀盐酸进行实验
下列叙述正确的是( )
- A、
滴定未知浓度的醋酸溶液时,用甲基橙作指示剂,会导致测定结果偏低
- B、 用湿润的
试纸测氯水的
值,测定值偏大
- C、 测定中和热时,将碱缓慢倒入酸中混合,所测温度值偏高
- D、 盐酸滴定未知浓度的
溶液时,滴定前滴定管尖嘴处有气泡,终点读数时无气泡,结果偏低




