选择题
下列药品和装置合理且能完成相应实验的是( )
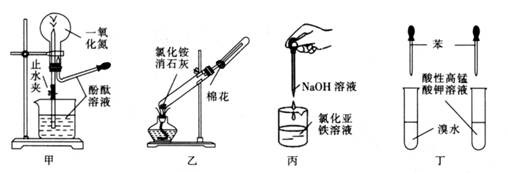
- A、 甲图为喷泉实验
- B、 乙图为实验室制取并收集氨气
- C、 丙图为制备氢氧化亚铁的实验
- D、 丁图为验证苯中是否有碳碳双键的实验
下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6 mol/L硫酸溶液、NaOH溶液。下列说法不正确的是( )

- A、 B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
- B、 实验开始时应先将活塞E关闭
- C、 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中
- D、 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
下图所示实验方案无法达到预期实验目的的是( )

- A、 用甲制备少量
- B、 用乙制备少量
- C、 用丙制备并收集
- D、 用丁比较Cl、C、Si的非金属性强弱
下列叙述正确的有( )
①合金的硬度一般比它的成分金属的硬度都大
②合金的熔点一般比它的成分金属的熔点都低
③改变原料的配比、变更制造合金的工艺,可得到不同性能的合金
④氢氧化亚铁在空气中加热可以得到氧化亚铁
⑤在制备氢氧化亚铁时需要将胶头滴管插入到液面以下
⑥合金的应用范围比纯金属更广
- A、 仅①②⑤⑥
- B、 仅①②③⑤⑥
- C、 仅②③④
- D、 全部
甲同学用FeCl2和烧碱制备Fe(OH)2;乙同学用如图装置制备Fe(OH)2 , 为了生成的产物不容易被氧化,下列说法不正确的是( )

- A、 配制溶液所用的蒸馏水通常要煮沸
- B、 甲同学可在FeCl2溶液的上面加一层植物油,以隔绝空气
- C、 乙同学装置①加入Fe和稀硫酸,②中加入烧碱溶液
- D、 乙同学应该先关闭止水夹,一段时间以后再打开止水夹
下图为制取白色Fe(OH)2的实验装置,分液漏斗中是稀硫酸,烧瓶中是Fe粉,b中是NaOH溶液。下列说法错误的是( )

- A、 NaOH溶液被煮沸过,目的是除去溶液中溶解的O2
- B、 反应过程中产生的H2能排除装置中的O2
- C、 分液漏斗对反应的速率有控制能力
- D、 e在实验开始时关闭,在生成Fe(OH)2时打开
下列图示方法能完成相应实验的是( )

- A、 用图①配制一定物质的量浓度的NaOH溶液
- B、 用图②在实验室制取Cl2
- C、 用图③探究碳酸氢钠和碳酸钠的热稳定性
- D、 用图④制备少量Fe(OH)2并能较长时间看到其白色
下列有关实验的操作方法或实验结论错误的是( )
- A、 用分液漏斗滴加液体时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔
- B、 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色,能制得氢氧化铁胶体
- C、 液溴保存应选用带玻璃塞的细口棕色试剂瓶,再在液溴上加一层水,并放在阴凉处
- D、 中和滴定实验中,盛标准液的滴定管滴定前无气泡、滴定后出现气泡,会使测定结果偏低
下列实验方案能达到实验目的的是(部分夹持装置已略去)( )
- A、
 验证木炭和浓硫酸反应生成
验证木炭和浓硫酸反应生成 - B、
 实验室制备
实验室制备并能较长时间观察到白色固体
- C、
 实验室制备和收集氨气并验满
实验室制备和收集氨气并验满 - D、
 制备乙酸乙酯
制备乙酸乙酯
下列实验能达到目的的是。( )
选项 | 目的 | 实验 |
A | 除去Cl2中的HCl气体 | 将混合气体通入盛有饱和食盐水的洗气瓶 |
B | 检验加碘食盐中的KIO3 | 向加碘食盐水中滴加淀粉溶液 |
C | 用Cu制备CuSO4 | 将Cu与稀硫酸混合 |
D | 制备Fe(OH)3胶体 | 向饱和FeCl3溶液中滴加NaOH溶液 |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验操作或装置正确的是( )

- A、 图甲装置可用于完成过滤操作
- B、 图乙可用于比较碳酸钠和碳酸氢钠的热稳定性
- C、 图丙可实现制备Fe(OH)2并观察其颜色
- D、 图丁表示为配制一定物质的量浓度NaOH溶液时称量溶质的操作
下列各图示中能较长时间看到 Fe(OH)2白色沉淀的是( )
(已知:苯为难溶于水且密度比水小的液体)




- A、 ①②③
- B、 ①②④
- C、 ①③④
- D、 ②③④
下列有关氢氧化亚铁及其制备方法的叙述中,错误的是( )

- A、 氢氧化亚铁易被空气氧化
- B、 氢氧化亚铁为灰绿色絮状沉淀
- C、 可利用上图所示装置,制备氢氧化亚铁
- D、 实验中所用氢氧化钠溶液应预先煮沸
下图所示实验方案无法达到预期实验目的的是( )

- A、 用图甲制备Fe(OH)2
- B、 用图乙制备少量Cl2
- C、 用图丙制备并收集O2
- D、 用图丁比较S、C、Si的非金属性强弱
下列实验装置的选择正确的是( )
| A | B | C | D |
| | | | |
| 称量氢氧化钠固体 | 氢氧化铁胶体的制备 | 检验溶液中的 | 配制500mL 1 |
- A、 A
- B、 B
- C、 C
- D、 D











