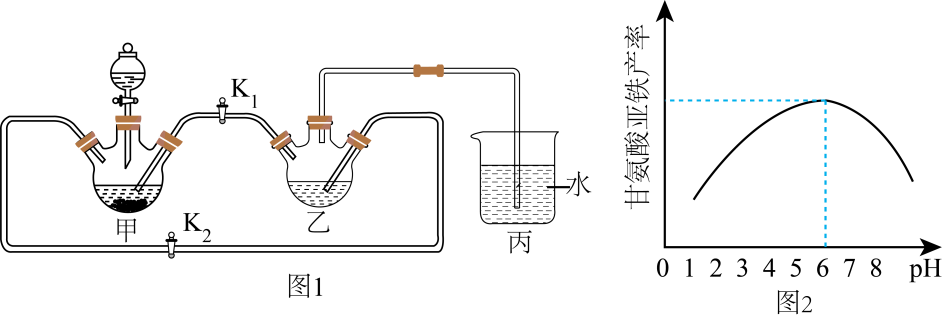选择题
实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
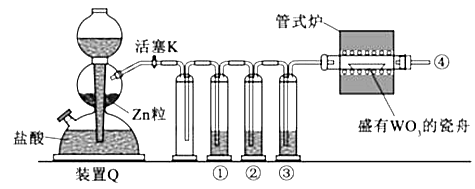
- A、 ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
- B、 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度
- C、 结束反应时,先关闭活塞K,再停止加热
- D、 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
下列说法错误的是( )
- A、 工序③和工序④顺序可互换
- B、 选择温度为80~90℃,可降低碳酸锂在水中的溶解度,提高产率
- C、 用乙醇洗涤粗产品可起到快速干燥的效果
- D、 利用重结晶可分离
和
Li和N2在450℃时反应制得储氢材料Li3N,Li3N易水解,在空气中加热可发生剧烈燃烧。下图是某实验小组设计的实验室制备少量Li3N的装置图。下面有关说法错误的是( )

- A、 洗气瓶a中盛放NaOH溶液
- B、 浓硫酸的作用是防止空气中的水蒸气和氧气进入d,避免Li3N水解和燃烧
- C、 反应时,先对d加热,再点燃c中酒精灯
- D、 取少量反应后固体,滴加酚酞溶液,若溶液变红不能说明反应后固体中含Li3N
1-丁醇、溴化钠和70%的硫酸共热反应,经过回流、蒸馏、萃取分液制得1-溴丁烷粗产品,装置如图所示:

已知:
下列说法正确的是( )
- A、 装置I中回流的目的是为了提高产率
- B、 装置II中a为进水口,b为出水口
- C、 用装置III萃取分液时,将分层的液体依次从下放出
- D、 蒸馏完毕后,应先停止通冷凝水,再停止加热
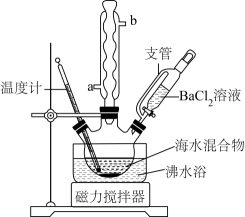
实验室制备硫氰酸钾的装置如图所示:
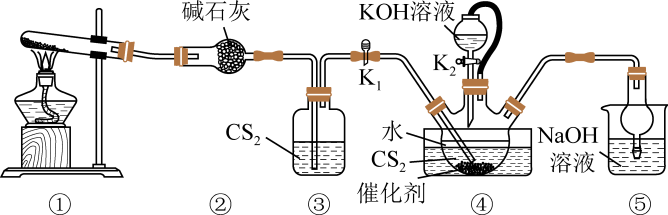
已知:;
密度大于水。下列说法错误的是( )
- A、 根据观察③中气泡流速调控①的加热温度
- B、 ④中长导管必须插入
液面以下
- C、 滴加
生成
的反应为
- D、 ⑤的主要作用为除去
, 防止空气污染
某同学分别用下列装置a和b制备溴苯,下列说法错误的是( )

- A、 两烧瓶中均出现红棕色气体,说明液溴沸点低
- B、 a装置锥形瓶中出现淡黄色沉淀,说明烧瓶中发生取代反应
- C、 b装置试管中CCl4吸收Br2 , 液体变红棕色
- D、 b装置中的倒置漏斗起防倒吸作用,漏斗内形成白烟
已知锰酸钾(K2MnO4)在浓的强碱溶液中可稳定存在,在强碱性K2MnO4溶液中通入CO2气体发生反应:3 +2CO2=2
+2CO2=2 +MnO2↓+2
+MnO2↓+2 , 当溶液的pH值达到10~11之间时,即停止通CO2 , 然后把溶液加热,趁热用砂芯漏斗抽滤,滤去MnO2残渣,即可制得KMnO4 , 下列用CO2与K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( )
, 当溶液的pH值达到10~11之间时,即停止通CO2 , 然后把溶液加热,趁热用砂芯漏斗抽滤,滤去MnO2残渣,即可制得KMnO4 , 下列用CO2与K2MnO4制备KMnO4的实验原理和装置不能达到实验目的的是( )

- A、 用装置甲制取CO2
- B、 用装置乙除去CO2中的HCl
- C、 用装置丙使K2MnO4转化成KMnO4
- D、 用装置丁分离出溶液中的MnO2
硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO)生产ZnSO4•7H2O的流程如图:

下列叙述错误的是( )
- A、 “溶浸”时搅拌可以加快“溶浸”速率,“滤渣A”的主要成分是PbSO4
- B、 NaClO的作用主要是将Fe2+氧化为Fe3+方便以沉淀的形式除去
- C、 “反应II”中,加入锌粉时反应的离子方程式为Cu2++Zn=Zn2++Cu
- D、 从滤液获得ZnSO4•7H2O的实验操作为蒸发结晶、洗涤、干燥
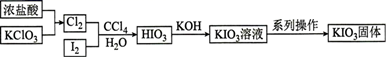
目前碘酸钾被广泛应用于食盐加碘。一种由含碘的酸性废水制取碘酸钾的工艺如下,其中“制 ”时,
”时, 会水解形成胶状物吸附
会水解形成胶状物吸附 , 造成
, 造成 的损失。下列说法正确的是 ( )
的损失。下列说法正确的是 ( )

- A、 滤渣1能够完全溶解于稀硫酸中
- B、 该流程涉及的化学反应均为氧化还原反应
- C、 制备
时要控制溶液的
不宜过大
- D、 制备
过程中,理论上消耗的
与
的物质的量之比为
ZnS常用于制造分析试剂荧光体、光导体材料、染料、涂料、颜料、玻璃、固化油等。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:

已知:常温下,;
;
。离子浓度小于10-5时,可认为沉淀完全,下列说法错误的是( )
- A、 常温下使Fe3+沉淀完全的最小
- B、 还原过程中加入的物质X可能是金属Zn
- C、 沉淀过程中发生反应的离子方程式为
- D、 第二次调节pH也可以用ZnO,但不能用
、