多选题
选择题
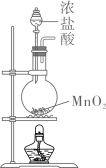
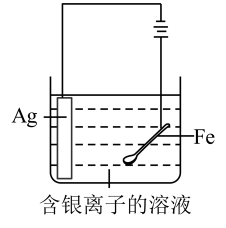
利用如图所示装置(夹持装置略)进行实验,b中现象不能证明a中产物生成的是( )
a中反应 | b中检测试剂及现象 | |
A | 浓 | 淀粉 |
B |
| 品红溶液褪色 |
C | 浓 | 酚酞溶液变红 |
D |
| 溴水褪色 |
- A、 A
- B、 B
- C、 C
- D、 D
依据下列实验,预测的实验现象正确的是( )
选项 | 实验内容 | 预测的实验现象 |
A |
| 产生白色沉淀后沉淀消失 |
B |
| 溶液变血红色 |
C | AgI悬浊液中滴加NaCl溶液至过量 | 黄色沉淀全部转化为白色沉淀 |
D | 酸性 | 溶液紫红色褪去 |
- A、 A
- B、 B
- C、 C
- D、 D
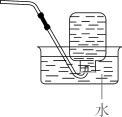
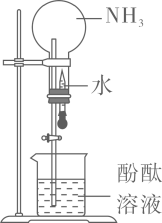
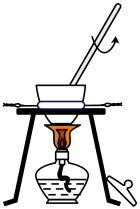
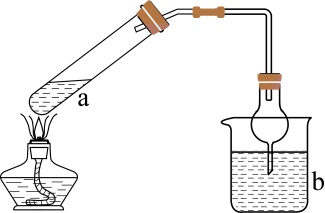
下列实验装置合理且能达到实验目的的是

- A、 用甲装置制备
- B、 用乙装置鉴别
和
- C、 用丙装置制备氢氧化铁胶体
- D、 用装置丁制取乙酸乙酯
如图所示实验操作正确的是
- A、
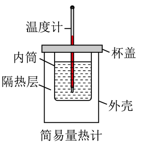 测定中和反应反应热
测定中和反应反应热 - B、
 除去Fe2(SO4)3溶液中的FeSO4
除去Fe2(SO4)3溶液中的FeSO4 - C、
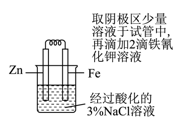 验证牺牲阳极法保护铁
验证牺牲阳极法保护铁 - D、
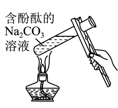 验证温度对水解平衡的影响
验证温度对水解平衡的影响
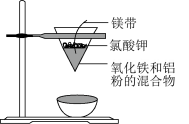
“化学多米诺实验”即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。如图是一个“化学多米诺实验”。
已知:①Cu2++4NH3·H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2分解的催化剂)
②A和C中的硫酸溶液浓度相同

下列有关分析错误的是
- A、 该实验成功的重要条件是整套装置气密性良好
- B、 C中现象为液面下降
- C、 B中反应速率大于D中反应速率
- D、 H中出现浅黄色浑浊
下列实验设计和操作合理的是
- A、 用浓硫酸与氯化钠固体共热制备HCl气体
- B、 用饱和碳酸钠溶液除去
中混有的少量HCl气体
- C、 用乙醛作萃取剂萃取溴水中的溴
- D、 用NaOH标准液滴定未知浓度的醋酸溶液,可以选择甲基橙做指示剂
用下列装置进行相应的实验,能达到实验目的的是
|
|
|
|
A.灼烧碎海带 | B.电镀银 | C.氧化还原反应滴定 | D.制备乙酸乙酯 |
- A、 A
- B、 B
- C、 C
- D、 D
某兴趣小组对氢氧化镁的溶解进行如图探究实验。下列说法错误的是

- A、 c(OH-):①=③
- B、 ③中存在:2c(Mg2+)>c(Cl-)
- C、 ③中溶液又变红的原因:沉淀溶解平衡正向移动
- D、 ①中存在沉淀溶解平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)
用下列实验装置进行相应实验,能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
目的 | 干燥CO2 | 提纯乙酸乙酯 | 发生铝热反应 | 制取Cl2 |
- A、 A
- B、 B
- C、 C
- D、 D
实验室用苯与溴反应制备溴苯,关于说法正确的是
- A、 可以用溴水代替液溴,减少溴的挥发
- B、 将生成气体直接通入
溶液,检验反应是否生成HBr
- C、 铁粉作催化剂,苯与溴既能发生加成反应,也能发生取代反应
- D、 反应后的混合液经稀碱溶液洗涤、分液、蒸馏,即可得到溴苯
与“用自来水制取蒸馏水”的原理相似的是( )
- A、 石油裂化
- B、 石油分馏
- C、 煤干馏
- D、 纸层析