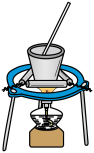
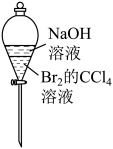
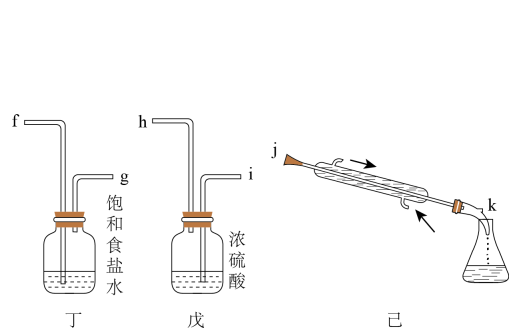
选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( )
- A、
 制取氨气
制取氨气 - B、
 制取NaHCO3
制取NaHCO3 - C、
 分离NaHCO3
分离NaHCO3 - D、
 干燥NaHCO3
干燥NaHCO3
下列实验操作能达到实验目的是( )
- A、 用长颈漏斗分离出乙酸与乙醇反应的产物
- B、 用向上排空气法收集铜粉与稀硝酸反应产生的NO
- C、 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
- D、 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
下列选用的仪器和药品能达到实验目的是( )
A | B | C | D |
|
| NaHSO3溶液
|
|
制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
- A、 A
- B、 B
- C、 C
- D、 D
下列叙述不正确的是( )
- A、 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
- B、 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
- C、 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
- D、 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管加蒸馏水至刻度线
实验室制取FeSO4溶液和NaHCO3溶液,并利用两者反应制取FeCO3 , 下列有关实验装置和操作不能达到实验目的的是

- A、 用装置甲制取FeSO4溶液
- B、 用装置乙制取NaHCO3溶液
- C、 用装置丙制取FeCO3
- D、 用装置丁过滤所得的浊液
下列装置能达到实验目的的是

- A、 从盐水中提取
- B、 除去
中的
- C、 制取收集氨
- D、 除去
中的
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
A | B | C | D | |
装置 |
|
|
|
|
- A、 蒸馏海水制淡水
- B、 稀释浓
- C、 吸收
- D、 制取乙酸乙酯
实验室从废定影液[含 和
和 等]中回收
等]中回收 和
和 的主要步骤为:向废定影液中加入
的主要步骤为:向废定影液中加入 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制
制 ;制取
;制取 并通入滤液氧化
并通入滤液氧化 , 用苯萃取分液。其中部分操作的装置如图,下列叙述正确的是
, 用苯萃取分液。其中部分操作的装置如图,下列叙述正确的是

- A、 用装置甲分离
时,用玻璃棒进行引流
- B、 用装置乙在空气中高温灼烧
制取
- C、 用装置丙制备
时还需要加热条件
- D、 用装置丁分液时,从下口放出有机相
下列装置能达到实验目的的是
|
|
|
|
A.从食盐水中提取NaCl | B.除 | C.制取并收集氨气 | D.检查装置的气密性 |
- A、 A
- B、 B
- C、 C
- D、 D
下列实验方案中不能达到实验目的的是

- A、 用装置①测量盐酸和氢氧化钠溶液反应前后的温度
- B、 用装置②除去Cl2中少量的HCl气体
- C、 用装置③可以说明氨气极易溶于水
- D、 用装置④检验1-溴丁烷和氢氧化钠乙醇溶液反应的产物