选择题(本题共20小题,每小题3分,共60分)
青山绿水就是金山银山,捡拾垃圾是有助于减少环境污染的一种简单方法。以下是小敏在江边检拾的垃圾,不属于有机物的是( )
- A、
 塑料瓶
塑料瓶 - B、
 泡沫饭盒
泡沫饭盒 - C、
 易拉罐
易拉罐 - D、
 垃圾袋
垃圾袋
如果发现农田里的作物叶色发黄,并且茎杆软弱容易倒伏,应该施用下列化肥( )
- A、 Ca3(PO4)2
- B、 KNO3
- C、 K2CO3
- D、 NH4H2PO4
实验室有一瓶保管不当的试剂,其残缺的标签如图,这瓶试剂的溶质可能是( )
![]()
- A、 单质
- B、 氧化物
- C、 盐
- D、 碱
下列选项中物质的名称、俗名、化学式完全一致的是()
- A、 氯化钠、食盐、NaCl
- B、 氢氧化钙、熟石灰、CaOH
- C、 氢氧化钠、纯碱、NaOH
- D、 碳酸氢钠、苏打、
下列反应中,属于复分解反应的是( )
- A、 H2O+CO2=H2CO3
- B、 CO2+2NaOH=Na2CO3+H2O
- C、 CuO+2HCl=CuCl2+H2O
- D、 Fe+CuSO4=FeSO4+Cu
食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能做成的实验是( )
①检验自来水中是否含有氯离子②鉴别食盐和纯碱
③检验鸡蛋壳能否溶于酸④除去热水瓶中的水垢
- A、 ①②③④
- B、 ①③
- C、 ②④
- D、 ②③④
下列物质敞口放置在空气中,溶质发生变质且溶液质量增加的是( )
- A、 石灰水
- B、 氢氧化钠溶液
- C、 浓盐酸
- D、 浓硫酸
下列试剂中,能把NaOH溶液、稀硫酸、BaCl2溶液一次鉴别出来的是( )
- A、 KCl溶液
- B、 K2CO3溶液
- C、 NaNO3溶液
- D、 稀盐酸
下列各组离子在pH=1的溶液中都能大量共存,且溶液呈无色的是( )
- A、 Ba2+、K+、NO3-、Cl-
- B、 Fe3+、Ca2+、NO3-、Cl-
- C、 Na+、K+、CO32-、SO42-
- D、 Cu2+、Mg2+、NO3-、SO42-
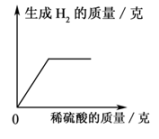
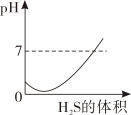
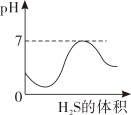
据图示判断X、Y、Z三种金属与氢的活动性由强到弱的顺序是( )
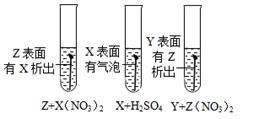
- A、 X>H>Y>Z
- B、 Y>Z>X>H
- C、 Z>Y>X>H
- D、 X>H>Z>Y
现有a.MgSO4;b.NaOH;c.CuSO4;d.NaCl四种溶液,不用外加试剂,用最简便的方法鉴别,正确顺序是( )
- A、 abed
- B、 bcda
- C、 cbad
- D、 cadb
在氢氧化钠溶液中加入一定量的稀硫酸后,下列实验能证明两者恰好完全中和的是( )
- A、 滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
- B、 滴入几滴酚酞试液,酚酞试液不变色
- C、 滴入适量BaCl2溶液和稀硝酸,观察到有白色沉淀
- D、 测得反应后溶液中Na+与SO2-个数比为2:1
除去下列物质中混有的少量杂质,下列方案不可行的是( )
选项 | 物质 | 杂质 | 方案 |
A | Cu粉 | Zn粉 | 加入足量CuCl2溶液后过滤、洗涤、干燥 |
B | CO气体 | CO2气体 | 通过足量的氢氧化钠溶液后干燥 |
C | NaCl固体 | Na2CO3固体 | 加入足量的稀硫酸后蒸发 |
D | BaCO3固体 | BaCl2固体 | 加水溶解后过滤 |
- A、 A
- B、 B
- C、 C
- D、 D
为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。下列操作顺序中最合适的是( )
- A、 ①④②⑤③
- B、 ④①②⑤③
- C、 ②⑤④①③
- D、 ⑤②④③①
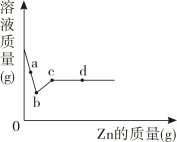
向一定质量的FeSO4和CuSO4的混合溶液中加入一定质量锌粉,充分反应后过滤,得滤液M和滤渣N。向滤渣N中加入稀盐酸,有气泡产生根据实验现象分析判断下列说法,不正确的是( )
- A、 滤液M中一定存在Zn2+ , 可能含有Fe2+
- B、 滤液M的颜色呈蓝色
- C、 滤渣N中一定含有Fe和Cu
- D、 滤渣N的质量小于加入锌粉的质量
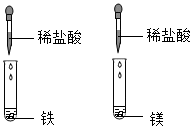
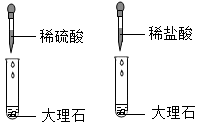
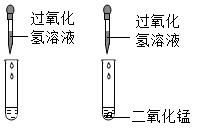
为研究碱的化学性质,小明进行了如下实验,其中实验现象描述错误的是( )
- A、
 溶液呈红色
溶液呈红色 - B、
 有白色沉淀生成
有白色沉淀生成 - C、
 无明显变化
无明显变化 - D、
 有蓝色沉淀生成
有蓝色沉淀生成
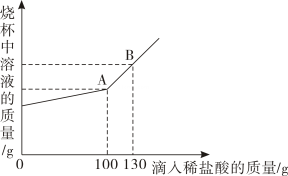
某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )
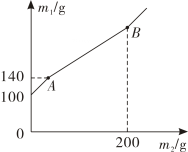

- A、 反应至A点时,所加NaOH溶液的质量为40g
- B、 反应至A点时,溶液中的溶质有CuCl2和NaCl
- C、 反应至B点时,锥形瓶内溶液的质量为280.4g
- D、 反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g