选择题(本大题共30小题,每题3分,共60分)
科学实验要规范操作,下列实验操作你认为正确的是( )
- A、 熄灭酒精灯

- B、 干燥氧气

- C、 测定某溶液的pH

- D、 检查气密性

归纳和演绎是重要的科学方法,下列归纳或演绎合理的是( )
- A、 纯净物是由一种物质组成的,所以纯净的空气是一种纯净物
- B、 酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应
- C、 镁和稀硫酸反应能产生氢气,所以能和稀硫酸反应产生气体的物质一定是金属
- D、 碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性
小科最近上腹部不适,经常反胃,经检查,原因是胃酸过多。下列数据为一些我市本地水果的近似pH,其中最适宜他吃的是( )
- A、
 翠冠梨pH=6.5
翠冠梨pH=6.5 - B、
 东魁杨梅pH=2.0
东魁杨梅pH=2.0 - C、
 桃形李pH=2.5
桃形李pH=2.5 - D、
 柿子pH=8.5
柿子pH=8.5
向一定量NaOH溶液中加水稀释,其pH与所加水的质量m的关系图正确的是( )
- A、

- B、

- C、

- D、

在空气中放置较长时间的锌片,表面会形成一层薄膜,其中含有Zn2(OH)2CO3。若该物质通过化合反应生成,反应物除了Zn外,还可能有N2、O2、CO2、H2O中的( )
- A、 一种
- B、 两种
- C、 三种
- D、 四种
不能用金属跟酸直接反应得到的物质是 ( )
- A、 氯化铜
- B、 氯化亚铁
- C、 氯化锌
- D、 氯化镁
如图为某化学反应的微观示意图,图中“●”表示硫原子,“O”表示氧原子。下列说法中错误的是( )

- A、 甲是SO2
- B、 该反应属于化合反应
- C、 反应前后,分子、原子种类均不变
- D、 反应中,甲、乙、丙三种物质的分子个数比为2:1:2
有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
- A、 HCl、BaCl2、Na2CO3、H2SO4
- B、 Na2CO3、BaCl2、H2SO4、HCl
- C、 H2SO4、HCl、Na2CO3、BaCl2
- D、 HCl、H2SO4、BaCl2、Na2CO3
下列除去杂质的方法中,正确的是( )
选项 | 物质(括号内为杂质) | 去除杂质的方法 |
A | NaCl(Na2CO3) | 加入适量的Ca(OH)2溶液、过滤 |
B | CaO(CaCO3) | 加水、过滤 |
C | Fe(Zn) | 加过量FeSO4溶液、过滤 |
D | H2SO4(HNO3) | 加Ba(NO3)2溶液、过滤 |
- A、 A
- B、 B
- C、 C
- D、 D
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
- A、 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
- B、 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
- C、 “青蒿一握,以水二升溃,绞取汁”,该过程对青蒿素的提取属于物理变化
- D、 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
下列物质存放在烧杯中,一段时间后,质量变大且变质的是 ( )
①浓盐酸 ②浓硫酸 ③烧碱 ④纯碱 ⑤生石灰 ⑥食盐
- A、 ①⑥
- B、 ②③④⑤
- C、 ②③④
- D、 ③⑤
下列物质混合后,不能发生复分解反应的一组是( )
- A、 K2SO4溶液和Ba(OH)2溶液混合
- B、 KCl溶液和Cu(NO3)2溶液混合
- C、 CuSO4溶液和NaOH溶液混合
- D、 CaCO3和HCI溶液
下列各组离子,能在酸性的溶液中大量共存且形成无色溶液的是( )
- A、 K+、Cu2+、SO42-、Cl-
- B、 CO32-、K+、Na+、Cl-
- C、 K+、SO42-、NO3-、Cl-
- D、 Ba2+、Cl-、Na+、SO42-
如图表示化学反应中溶液的颜色变化。下列叙述不正确的是( )

- A、 若X是稀盐酸,a可能是紫色石蕊试液
- B、 若X是稀盐酸,b可能是氧化物
- C、 若X是稀硫酸,c不可能是单质
- D、 若X是稀硫酸,d不一定是碱类物质
向盛有盐酸和氯化镁混合溶液的烧杯中加入一定量的氢氧化钠溶液,充分反应后发现有沉淀产生,过滤后得到滤液。有关滤液的成分,下列说法正确的有( )
①滤液中可能含有HCl②滤液可能只含有1种溶质
③取少量滤液于试管中,加入CuSO4溶液,无明显现象,则滤液一定含2种溶质
④取少量滤液于试管中,加入NaOH溶液,无明显现象,则滤液中可能含有NaOH
- A、 1个
- B、 2个
- C、 3个
- D、 4个
初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生。下列实验操作中“先”“后”顺序正确的是( )
- A、 实验室用高锰酸钾制取氧气,停止加热时,应先熄灭酒精灯,再把导管移出水面
- B、 测未知溶液pH值,应先将pH试纸浸入待测溶液中,再与标准比色卡比较
- C、 浓硫酸不慎溅到皮肤上,要先用大量清水冲洗,后用干布擦干,最后涂抹小苏打
- D、 用氢气还原氧化铜时,应先通一段时间的氢气,后点燃酒精灯进行实验
下列各图像能正确反映对应变化关系的是( )
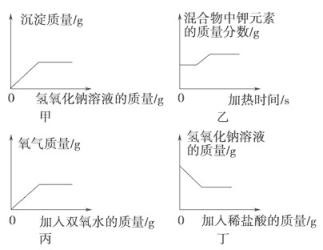
- A、 甲表示向一定量硫酸铜和硫酸混合液中加入氢氧化钠溶液
- B、 乙表示加热一定量氯酸钾和二氧化锰的混合物
- C、 丙表示向盛有少量二氧化锰的烧杯中不断加入双氧水
- D、 丁表示向一定量氢氧化钠溶液中加入稀盐酸













