选择题(每小题3分,16小题,共48分)
如图是生活中常见水果的pH值。其中酸性最强的水果是( )
![]()
- A、 乌梅
- B、 葡萄
- C、 香蕉
- D、 西瓜
铁路轨道建设中用到铝热反应对钢轨中的缝隙进行焊接,其原理为:
Fe2O3+2Al![]() Al2O3+2Fe,该反应属于( )
Al2O3+2Fe,该反应属于( )
- A、 化合反应
- B、 分解反应
- C、 复分解反应
- D、 置换反应
酸雨是指pH<5.6的酸性降水,分为硫酸型酸雨和硝酸型酸雨。为鉴别酸雨类型是否为硫酸型,可以采用的试剂为( )
- A、 氯化钡溶液
- B、 氢氧化钠溶液
- C、 硫酸铜溶液
- D、 紫色石蕊试液
为了使稻田里的水稻生长旺盛,茎秆粗壮,增强抗病虫害能力,可向稻田里施用的化肥是( )
- A、 NH4NO3
- B、 Ca3(PO4)2
- C、 NH4Cl
- D、 KCl
下列物质的名称、化学式、俗称不一致的是( )
- A、 碳酸钠、Na2CO3、纯碱
- B、 乙醇、C2H5OH、酒精
- C、 氧化钙、CaO、消石灰
- D、 氢氧化钠、NaOH、烧碱
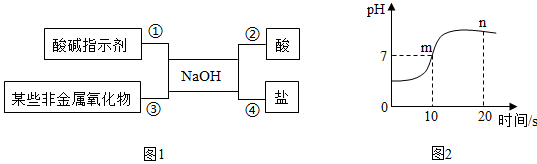
如图表示各种概念之间的关系,下列表述与图示相符的是( )

- A、 若①表示碱,②可以是纯碱
- B、 若①纯净物,②可以是单质
- C、 若①表示混合物,②可以是冰水混合物
- D、 若①表示中和反应, ②可以是复分解反应
2023杭州亚运会结束了,此次亚运会用到的物品哪个是有机合成材料制作而成( )
- A、 亚运会的金牌
- B、 亚运场馆轻型耐腐蚀塑料凳
- C、 亚运村食品级304不锈钢杯子
- D、 亚运会餐馆中国特色的竹筷子
小光和小亮就课本中的如图话题进行了思考和讨论,小光决定通过手捂增大铁屑的内能,小亮决定通过振荡方式增大铁屑的内能,以下分析正确的是( )

- A、 小光所用的方法,温度从手传递到了铁屑
- B、 当小光的手和铁屑所含内能相同时,热传递就会停止
- C、 从能量转化过程来看,小亮的方法和钻木取火是相同的
- D、 小光和小亮的方法对改变铁屑的内能是不等效的
在加压降温条件下,氯气(Cl2) 可液化为油状液体(液氯Cl2),氯气溶于水得到的溶液叫氯水,其中部分氯气会与水反应生成HCl和HClO (次氯酸)。小陈做了分析,合理的是( )
- A、 氯气变成液氯是物理变化
- B、 氯气与水的反应属于复分解反应
- C、 往氯水中滴加碳酸钠溶液不会有气泡生成
- D、 往氯水中滴加硝酸银溶液后无明显现象
一氧化碳、木炭粉分别与黑色的氧化铜粉末反应时,下列叙述错误的是( )
- A、 反应均需在加热或高温条件下进行
- B、 都有红色的单质铜生成
- C、 反应中,氧化铜都被还原,氧化铜是氧化剂
- D、 都是置换反应
“金银铜铁锡”俗称五金,相关叙述正确的是( )
- A、 黄铜(铜锌合金)比铜的硬度小
- B、 五种金属中,金属铜的导电性最弱
- C、 “金银铜铁锡”是按照金属活泼性由弱到强的顺序排列的
- D、 五种金属中,只有两种金属能和酸发生置换反应生成氢气
非洲旱季,常用Hippo roller(中间有转轴的塑料桶)运水。小华分别用背背、用手抱、用手平拉、滚拉的方式运满桶水,在粗糙程度相同的水平地面上匀速行走相同路程,她对满桶水做功最多的是( )
- A、

- B、

- C、

- D、

将质量相等、颗粒大小也相同的锌、铁两种金属,同时分别放入质量分数相同且质量相等的稀盐酸中,反应生成的氢气与反应时间的关系如图所示。根据图中所提供的信息,得出的结论错误的是( )

- A、 折线X表示锌的反应情况
- B、 锌和铁都已经被完全反应
- C、 生成氢气的质量相等
- D、 盐酸都已经被完全反应
下列选项中,除去杂质的方法正确的是( )
选项 | 物质 | 杂质 | 除杂方法 |
A | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
B | K2CO3溶液 | KCl | 加适量稀盐酸 |
C | CaO | CaCO3 | 加水,过滤 |
D | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |
- A、 A
- B、 B
- C、 C
- D、 D
科学兴趣小组的同学就以下物质的鉴别方案展开了讨论,其中不正确的是( )
- A、 利用CO2气体就能区分NaOH、Ca(OH)2和稀盐酸三种溶液
- B、 若有BaCl2溶液,就有办法鉴别NaOH、Na2CO3、Na2SO4
- C、 有酚酞溶液,就能鉴别盐酸、Na2CO3和KNO3三种溶液
- D、 不用其它任何试剂就能将HCl、BaCl2、Na2CO3三种溶液鉴别出来
投掷实心球是体育中考项目之一。若不计空气阻力,实心球从离手到落地前的过程中,下列关于其动能、势能和机械能的大小分别随时间变化的曲线中( )

- A、 ①③④
- B、 ②③④
- C、 ①④
- D、 ③④