试题详情
氨是重要的化工产品之一,研究合成氨反应具有重要意义.σ
(1)已知断裂下列化学键需要吸收的能量分别为:N≡N 946.0kJ•mol﹣1、H﹣H 436kJ•mol﹣1、N﹣H 390.8kJ•mol﹣1 , 写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式
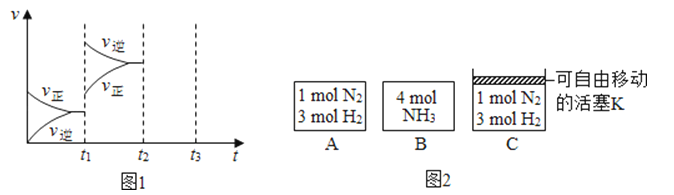
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如图1所示:
①t1时刻改变的条件为
②t2时刻,恒压充入氦气,t3时刻达到平衡.在图中画出t2时刻后的速率变化图象.
(3)相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图2所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡.
①达到平衡时,A、C两个容器中NH3的浓度分别为c1、c2 , 则c1 c2(填“>”、“<”或“=”).
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A)、α(B),则 α(A)+α(B) 1(填“>”、“<”或“=”).
③达到平衡时,若容器C的体积是起始时的 , 则平衡时容器C中H2的体积分数为
(4)直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2═2N2+6H2O,则负极的电极反应式为
知识点

参考答案
采纳过本试题的试卷