试题详情
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害.对废旧电池进行资源化处理显得非常重要.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源.
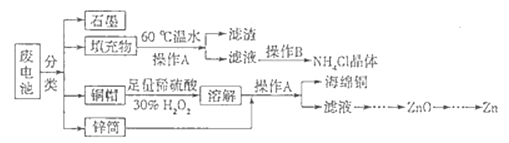
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是
(3)操作A的名称为
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.
①当1mol MnO2参加反应时,共有 mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示).铜帽溶解完全后,可采用 方法除去溶液中过量的H2O2 .
(6)锌锰干电池所含的汞可用KMnO4溶液吸收.在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图所示:
根据图可知:

①pH对Hg吸收率的影响规律是
②在强酸性环境下Hg的吸收率高的原因可能是
知识点

参考答案
采纳过本试题的试卷