试题详情
H2C2O4为二元弱酸,Ka1= 5.9×10−2 , Ka2= 6.4×10−5 , lg6.4 ≈ 0.8,向20mL0.1mol∙L−1 H2C2O4溶液中滴加0.2mol∙L−1KOH溶液,溶液中含碳微粒的存在形式与物质的量百分比随KOH溶液体积变化如图所示。下列说法正确的是( )
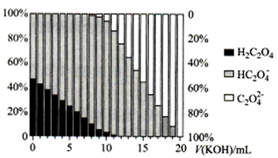
- A、滴入10 mL KOH溶液时,溶液呈中性
- B、当c(
)=c(
)时,混合溶液pH≈4.2
- C、滴入10 mL KOH溶液时,溶液中有如下关系:c(H2C2O4)+c(
)+c(
)=0.1mol∙L−1
- D、滴入16~20 mL KOH溶液的过程中,均满足c(
)>c(
)>c(H+)>c(OH−)
知识点

参考答案
采纳过本试题的试卷