试题详情
将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[Co(H2O)6]2++4Cl- [CoCl4]2-+6H2O△H。用该溶液做实验,溶液的颜色变化如图:
[CoCl4]2-+6H2O△H。用该溶液做实验,溶液的颜色变化如图:
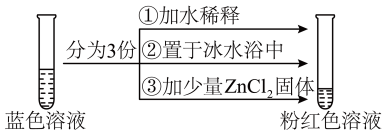
已知:[Co(H2O)6]2+粉红色、[CoCl4]2—蓝色、[ZnCl4]2-无色,下列结论和解释正确的是( )
- A、[Co(H2O)6]2+和[CoCl4]2—的Co2+配位数之比为2︰3
- B、由实验①可知平衡逆向移动
- C、由实验②可推知△H<0
- D、由实验③可知配离子的稳定性:[ZnCl4]2-<[CoCl4]2-
知识点

参考答案
采纳过本试题的试卷