试题详情
已知草酸为二元弱酸:H2C2O4  HC2O4-+ H+ Ka 1 ; HC2O4-
HC2O4-+ H+ Ka 1 ; HC2O4-  C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
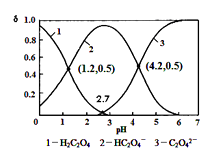
- A、常温下,Ka1 :Ka2 =1000
- B、将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液
- C、pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4)
- D、向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
知识点

参考答案
采纳过本试题的试卷