试题详情
羟胺的电离方程式为: NH2OH+H2O  NH3OH++OH-( 25℃时, Kb=9.0×10-9)。用 0.1 mol·L-1 盐酸滴定 20 mL 0.1mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(已知: lg3=0.5)。下列说法正确的是( )
NH3OH++OH-( 25℃时, Kb=9.0×10-9)。用 0.1 mol·L-1 盐酸滴定 20 mL 0.1mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(已知: lg3=0.5)。下列说法正确的是( )
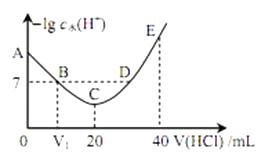
- A、图中 V1>10
- B、A 点对应溶液的 pH=9.5
- C、B, D 两点对应的溶液均为中性
- D、E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)