单选题
下列四幅坐标图分别表示物质化学反应中所表现出来的一些特征,其中与选项表述不符合的是( )
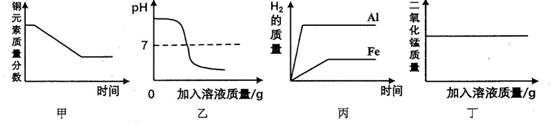
- A、 甲:将一氧化碳气体通入足量的灼热氧化铜固体中,铜元素质量分数变化
- B、 乙:向一定量的氢氧化钡溶液中滴加稀硫酸溶液,溶液的pH变化
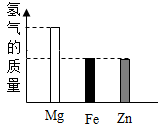
- C、 丙:分别将等质量的铝和铁放入足量的盐酸中,放出H2的质量的变化
- D、 丁:向一定量的二氧化锰固体中加入过氧化氢溶液,二氧化锰质量的变化
在密闭容器中放入甲、乙、丙、丁四种物质,一定条件下发生化学反应,一段时间后,测得相关数据如图所示,下列说法正确的是( )
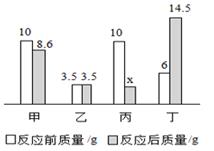
- A、 X=3.1
- B、 物质甲与丁质量比为14:85
- C、 该反应属于置换反应
- D、 乙一定是该反应的催化剂
向一定量的硝酸铜、硝酸银的混合溶液中加入5.6g铁粉,充分反应后过滤、洗涤、干燥,称得固体14g。向固体中加入稀盐酸,无气泡产生。则下列分析正确的是( )
- A、 滤液中一定不含有硝酸银
- B、 滤液中一定含有硝酸铜
- C、 滤出的固体中含有银7.6g
- D、 滤出的固体中含有铜6.4g
将10g氧化铜粉末加入到100g一定质量分数的稀硫酸中,微热到氧化铜全部溶解,再向溶液中加入ag铁粉,使溶液中的溶质完全反应后,过滤,将滤渣在低温下烘干,得到干燥固体质量仍然为ag,下列分析不正确的是( )
- A、 稀硫酸中溶质质量分数为12.25%
- B、 滤渣中一定含有铜,可能含有铁
- C、 加入铁粉后有红色固体产生,还有少量气泡产生
- D、 a的取值范围:a≥8
将苯(C6H6)和氧气置于一个完全密闭的容器中引燃,反应生成二氧化碳、水和 X。已知反应前后各物质的质量如下:则下列有关说法正确的是( )
| 物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
| 反应前的质量(g) | 3.9 | 9.6 | 0 | 0 | 0 |
| 反应后的质量(g) | 0 | 0 | 6.6 | 2.7 | m |
- A、 m 等于 4.0
- B、 X 由碳、氧两种元素组成
- C、 X 由碳、氢两种元素组成
- D、 生成物中二氧化碳和水的分子个数比为 3∶1
A、B、C三种物质各15克,它们化合时只能生成30克新物质D。若增加10克A,则反应停止后,原反应物中只剩余C。根据上述条件推断下列说法中正确的是( )
- A、 第一次反应停止后,B剩余9克
- B、 第二次反应后,D的质量为50克
- C、 反应中A和B的质量比是3:2
- D、 反应中A和C的质量比是5:3
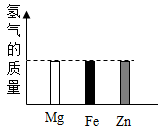
有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是( )
- A、 0.2g
- B、 0.6g
- C、 0.8g
- D、 0.9g
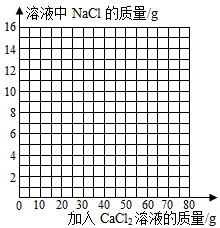
13.5gCuCl2样品,当与足量的AgNO3溶液反应后,得到29gAgCl沉淀,则样品中不可能混有的盐是( )
- A、 BaCl2
- B、 CaCl2
- C、 AlCl3
- D、 NaCl
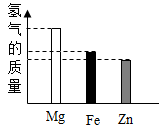
相同质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,对产生氢气质量(直接用各金属表示)的大小关系有以下几种猜测:①Mg>Al>Zn;②Al>Mg>Zn;③Al=Mg=Zn;④Al=Mg>Zn;⑤Al=Zn>Mg;⑥Al>Mg=Zn。其中合理猜测的个数为( )
- A、 5个
- B、 4个
- C、 3个
- D、 2个
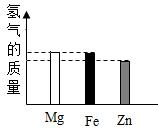
在已平衡的天平两边分别放一个等质量的烧杯,烧杯中装有等质量、等质量分数的足量稀盐酸,在左边烧杯中加入5.6g金属铁,在右边烧杯中加入5.5g镁和铜的混合物,充分反应后天平仍然保持平衡,则右边烧杯中加入的混合物中镁和铜的质量比为( )
- A、 36∶19
- B、 12∶43
- C、 24∶31
- D、 13∶42
在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如表中所示(已知甲、丙两种物质的式量比为1∶1),则下列说法正确的是( )
| 四种物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 2 | 8 | 30 | 50 |
| 反应后质量/g | 20 | 待测 | 39 | 23 |
- A、 该反应为化合反应
- B、 待测值为18
- C、 反应中丁和丙的质量比为3∶1
- D、 甲、丙两种物质化学计量数之比为1∶2
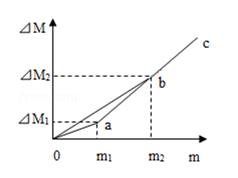
在反应A+3B=2C+3D中,已知A和B的相对分子质量之比为7∶8,当2.8g A与一定量B恰好完全反应后,生成3.6gD,则C的质量为( )
- A、 9.6g
- B、 8.8g
- C、 6.8g
- D、 4.4g
下列四个图象反映对应变化关系正确的是( )
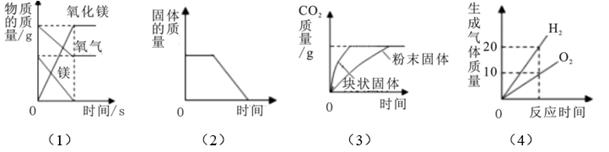
- A、 图(1)是一定量的镁在过量的氧气中充分燃烧
- B、 图(2)是红磷在密闭容器中燃烧
- C、 图(3)是等质量的碳酸钙与足量溶质质量分数相同的稀盐酸反应
- D、 图(4)是电解水实验,生成的氢气和氧气之间的质量关系
下列图象中,其对应变化关系错误的是( )

- A、 图①表示加热一定量碳酸氢铵,试管中固体的质量变化
- B、 图②向稀硫酸中不断加入氢氧化钡溶液
- C、 图③向一定量的烧碱溶液中加入稀盐酸
- D、 图④向一定量的CuSO4溶液中加NaOH溶液
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表:
| 物 质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(克) | 18 | 1 | 2 | 32 |
| 反应后质量(克) | x(未知) | 26 | 2 | 12 |
下列说法中,不正确的是( )
- A、 x为13
- B、 乙是反应物
- C、 反应中乙、丁的质量比为5∶4
- D、 物质丙可能是该反应的催化剂
有一不纯的碳酸钙样品,已知含有碳酸钠、碳酸钾、碳酸镁或碳酸钡中的一种或几种杂质,10g样品与足量的盐酸反应生成4.4g二氧化碳,则该样品中的杂质是( )
- A、 只有碳酸镁
- B、 只有碳酸镁和碳酸钡
- C、 必有碳酸镁,还有碳酸钠、碳酸钾的一种或两种
- D、 必有碳酸镁,还有碳酸钠、碳酸钾、碳酸钡的一种或几种
金属单质A和非金属单质B可生成化合物,反应的化学方程式为2A+B  A2B。
A2B。
某校甲、乙、丙三位同学分别在实验室内做该实验,充分反应时,所用A和B的质量a和b各不相同,但总质量相等,都是10.0g。有关实验数据记录如下。
| A的用量 | B的用量 | A2B的质量 | |
| 甲 | 9.0g | 1.0g | 5.0g |
| 乙 | 4.0g | 6.0g | 5.0g |
| 丙 | ag | bg | 6.0g |
下列说法正确的是( )
- A、 A与B的相对分子质量之比是4:1
- B、 丙同学实验中a:b的值可能是22:3
- C、 该反应一定不是氧化反应
- D、 A2B可能是水
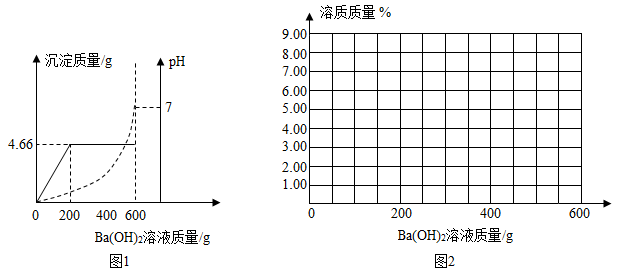
将等质量的CaCO3(块状)和Na2CO3(粉末),分别浸入一定量10%盐酸溶液质量中,产生CO2的质量随时间变化曲线如图所示,下列说法正确的是( )
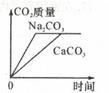
- A、 CaCO3(块状)一定有剩余
- B、 两者消耗的HCl质量不相等
- C、 消耗CaCO3与Na2CO3的质量比为1:1
- D、 CaCO3(块状)与盐酸反应速率更快