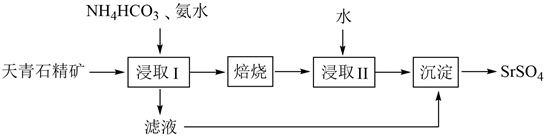
单选题
目前认为乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
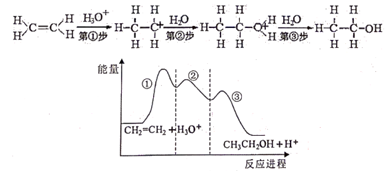
- A、 第①步反应的中间体比第②步反应的中间体稳定
- B、 总反应速率由第①步反应决定
- C、 第③步反应原子利用率为100%
- D、 总反应为吸热反应
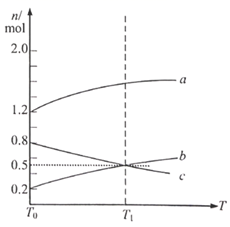
在温度T1和T2时,分别将0.50 mol A和1.2 mol B充入体积为3 L的恒容密闭容器中,发生如下反应:A(g)+2B(g)  2C(g)+D(g),测得n(A)随时间变化数据如下表,下列说法正确的是( )
2C(g)+D(g),测得n(A)随时间变化数据如下表,下列说法正确的是( )
| 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
| T1 | n(A)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(A)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
- A、 温度:T1>T2
- B、 反应达到平衡状态时,容器内压强不再发生变化
- C、 在温度T1时,0~10 min用B表示的平均反应速率为0.005mol/(L·min)
- D、 保持其他条件不变,缩小反应容器体积,逆反应速率增大,正反应速率减小
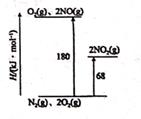
蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为( )SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1 , 标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法错误的是
- A、 该反应的ΔS>0
- B、 ΔH2<-41.8kJ·mol-1
- C、 SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态
- D、 标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×1023
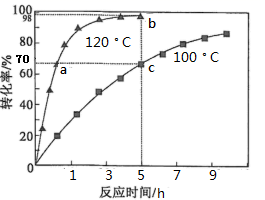
 ,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为x mol·L-1 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( )
,为了提高过氧化氢异丙苯的转化率,反应进行时需及时从溶液体系中移出部分苯酚。过氧化氢异丙苯的转化率随反应时间的变化如图所示。设过氧化氢异丙苯的初始浓度为x mol·L-1 , 反应过程中的液体体积变化忽略不计。下列说法正确的是( )