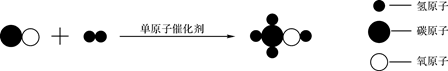
单选题
二氧化氯是新一代自来水消毒剂,如图为制取二氧化氯的化学反应模型。下列有关说法正确的是( )

- A、 参加反应的X、Y个数之比为2:1
- B、 该反应属于复分解反应
- C、 氯元素在物质Y中显-1价
- D、 X、Y、Z、W均为化合物
分类是科学的重要思想和方法,如图可表示纯净物、单质、化合物、氧化物之间的关系,若整个大圆圈表示纯净物,则下列物质中属于 Z 范围的是( )
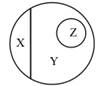
- A、 臭氧
- B、 小苏打
- C、 氧化钙
- D、 酒精
瑞德西韦一度被认为是治疗新冠肺炎较为有效的药物,其主要成分的化学式是C27H35N6O8P,对此分析可得出的信息是( )
- A、 相对分子质量为602克
- B、 一个C27H35N6O8P,分子中有35个氢原子
- C、 该分子由五种元素组成
- D、 该物质是氧化物
镓酸锌是一种新型半导体发光材料,它的化学式为ZnGa2O4(或ZnO·Ga2O3)。镓酸锌在紫外线或低压电子的激发下能发出很纯的蓝光。镓酸锌也是一种新型光催化材料,能将CO2高效转化为甲醇(CH3OH),其化学反应模型如图所示。下列叙述中,错误的是( )

- A、 镓酸锌中镓元素的化合价为+3价
- B、 上述反应前后镓酸锌质量不变
- C、 上述反应中的反应物和生成物都属于化合物
- D、 在紫外线或低压电子激发下的镓酸锌是一种光源
金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有FeWO4(钨酸亚铁)]制得金属钨(W)的工艺流程如图所示:

其主要反应原理如下:
① 4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4CO2
② Na2WO4+2HCl(热浓)=H2WO4+2NaCl
③ H2WO4 H2O+WO3
④ 3H2+WO3 W+3H2O
下列说法不正确的是( )
- A、 以上化学反应中缺化合反应这种基本反应类型
- B、 反应①②③④的产物都有氧化物
- C、 反应①④中有元素的化合价发生改变
- D、 为加快反应的速率,可将黑钨矿石碾成粉末
2017年1月27日,南京理工大学化学学院胡炳成团队成功合成世界上首个超高能全氨阴离子(N5-)钴(Co)盐[化学式为:Co(N5)(H2O)4],下列有关说法正确的是( )。
- A、 该物质属于混合物
- B、 该物质中钴元素的质量分数比氧元素的质量分数小
- C、 该物质中钻元素的化合价为+5价
- D、 N、H质量比为34:25
如图形象地表示体系I和II中分子种类及其数目,有关I→II的变化过程,下列说法不正确的是( )

- A、 该过程发生了置换反应
- B、
 在该变化中可能作催化剂
在该变化中可能作催化剂 - C、 该变化可以表示氮气与氢气生成氨气(NH3)的反应
- D、 体系I中所有物质都是单质
如图是2019年为庆祝中华人民共和国成立70周年发行的双金属铜合金纪念币。该纪念币材质为多种金属包钢铸造,属于金属合金。下列相关说法不正确的是( )

- A、 形成合金后,合金往往比纯金属具有更好的性能
- B、 把纪念币投入到足够的稀盐酸中,最后不会有固体剩余
- C、 从物质的分类角度看,该纪念币属于混合物
- D、 从物质的材料角度看,该纪念币属于金属材料
金属镍被广泛用于混合动力汽车电池,关于镍及其化合物存在下列反应:
①Ni+2HCl=NiCl2+H2↑; ②Ni(OH)2+2HCl=NiCl2+2H2O;
③NiO2+4HCl=NiCl2+Cl2↑+2H2O。以下分析正确的是( )
- A、 反应①②③中的Ni元素的化合价均发生变化
- B、 镍能与硝酸银溶液发生反应
- C、 Ni(OH)2和NiO2均属于氧化物
- D、 反应①是置换反应,反应③是复分解反应
归纳和演绎是重要的科学方法。下列归纳或演绎合理的是( )
- A、 有机物是一类含碳化合物,所以CH4、CO2都是有机物
- B、 稀有气体可做保护气,可做保护气的一定是稀有气体
- C、 金属Fe、Zn能与酸反应生成氢气,所以金属都能与酸反应生成氢气
- D、 单质是由一种元素组成,由一种元素组成的纯净物一定是单质
逻辑推理是一种重要的化学思维方法。以下推理正确的是( )
- A、 氧化物中含有氧元素,含氧元素的化合物一定是氧化物
- B、 单质中只含有一种元素,只含有一种元素的物质一定是单质
- C、 碱性溶液能使无色酚酞溶液变红,能使无色酚酞溶液变红的溶液一定是碱性溶液
- D、 可燃物燃烧时温度需要达到着火点,温度达到着火点时可燃物一定能燃烧
一款变色眼镜的各部分物质组成如图所示,其中玻璃镜片加入了溴化银(AgBr)和氧化铜。在强光照射下,溴化银分解成溴和银,玻璃颜色变深;光线较暗时,溴和银在氧化铜作用下重新生成溴化银,玻璃颜色变浅。则下列说法正确的是( )

- A、 固定镜腿的铜螺丝属于金属氧化物
- B、 在强光照射下,溴化银发生复分解反应,生成两种单质
- C、 在强光照射下,玻璃镜片中的银元素的化合价升高
- D、 光线较暗时,氧化铜在生成溴化银的反应中作催化剂
分析下列反应所得结论中,错.误.的是( )
①H2SO4(浓)+Na2SO3=Na2SO4+SO2↑+H2O
②Na2SO3+SO2=Na2S2O5
③2Na2O2+2CO2=2Na2CO3+O2
④2H2S+SO2=2H2O+3S↓
- A、 只有①属于复分解反应
- B、 只有②属于化合反应
- C、 只有③中氧元素的化合价改变
- D、 只有④有单质生成
下列哪项是淀粉、纤维素和糖原的共同特征( )
- A、 组成它们的单体都是葡萄糖
- B、 都可以被人体细胞直接吸收利用
- C、 都共同存在于动植物细胞中
- D、 都是细胞内贮存能量的主要物质
部分有机物分子组成和结构的表示方法如下:
| 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | |
| 分子式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
|
| | | | | |
据此推测己烷完全燃烧产生二氧化碳和水的质量比为( )
- A、 3:7
- B、 44:21
- C、 6:7
- D、 11:12
类推是一种重要的学习方法,但如果不具体问题具体分析就会产生错误的结论。下列类推结论错误的是( )
①CO能与Fe2O3反应生成Fe,CO也能与CuO反应生成Cu
②NaOH溶液能使无色酚酞试液变红色,Cu(OH)2也能使无色酚酞试液变红色
③有机化合物含碳元素,则含碳元素的化合物一定是有机化合物
④酸碱反应生成盐和水,则生成盐和水的反应一定是酸碱反应
⑤碱溶液呈碱性,能使无色酚酞变红,则呈碱性的溶液一定是碱溶液。
- A、 ②③④⑤
- B、 ①②⑤
- C、 ①⑤
- D、 ③④⑤
如图表示的是纯净物、单质、化合物、含氧化合物、氧化物之间的包含与被包含关系,若整个大圆代表纯净物,则①③所属的类别是( )
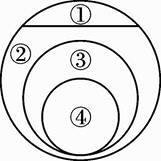
- A、 ①化合物、③氧化物
- B、 ①化合物、③含氧化合物
- C、 ①单质、③氧化物
- D、 ①单质、③含氧化合物
衣服上沾有碘极难洗净。由下表分析,在家庭中去碘污渍最好选用( )
溶质 | 溶剂 | |||
碘 | 水 | 酒精 | 苯(一种有机物,有毒) | 汽油 |
难溶 | 可溶 | 易溶 | 易溶 | |
- A、 水
- B、 苯
- C、 汽油
- D、 酒精
染发时一般要用到一种着色剂“对苯二胺”,它是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的说法错误的是( )

- A、 对苯二胺的化学式为C6H8N2
- B、 对苯二胺属于有机物
- C、 对苯二胺中氢元素和氮元素的质量比为2:7
- D、 对苯二胺有毒属于物理性质